生信分析+下游验证,发到了顶刊11.4,现在还是红利期,赶紧行动起来吧!
题目:泛癌分析揭示乳酸代谢在免疫治疗反应预测和生存预测新的见解
英文名:Pan-cancer analysis implicates novel insights of lactate metabolism into immunotherapy response prediction and survival prognostication
杂志:Journal of Experimental & Clinical Cancer Research
影响因子:11.4
研究背景:免疫疗法已经成为一种有效的临床癌症治疗方法,靶向肿瘤细胞中的乳酸代谢(LM)作为增强抗肿瘤免疫反应的方法是一种有前景的治疗策略。作者利用scRNA-seq数据和多种机器学习(ML)算法,在泛癌水平上揭示了LM和免疫治疗耐药性之间的紧密相关性,并进一步建立了一种新的LM相关特征基因集(LM. SIG),为患者选择合适的免疫治疗提供了参考。
研究思路:


图1
作者首先在两个免疫疗法scRNA-seq数据集中说明并验证了LM与免疫治疗反应之间是存在负相关的。随后,基于40个泛癌scRNA-seq队列建立了LM相关特征基因集(LM.SIG),然后,基于8个免疫治疗转录组队列和30个癌症基因组图谱(TCGA)泛癌数据集,采用15种机器学习(ML)算法来验证LM.SIG在免疫治疗反应预测和生存预测方面的能力。此外,作者还基于17个CRISPR数据集,筛选了免疫治疗潜在的靶点,通过下游实验在胰腺癌类器官中进行了验证。
研究结果:
1、 LM上调与免疫治疗耐药相关
作者对2个免疫治疗的scRNA-seq数据集进行分析,计算LM的相关基因的得分,结果表明,LM水平升高的恶性细胞在无应答(NR)组内表现出富集(图2A),这个结果在另一个数据集得到验证(图2C-D),这些结果共同表明LM与免疫治疗耐药有关。
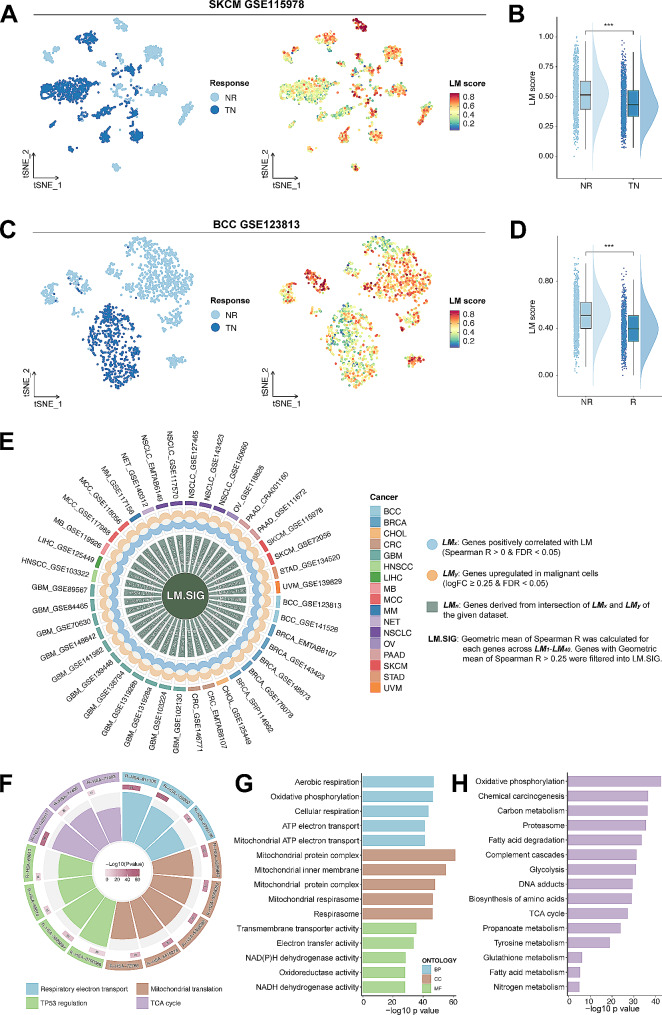

图2
2、 使用泛癌scRNA-seq队列建立LM. SIG
作者利用泛癌scRNA-seq队列数据,进行GSVA分析,筛选与LM相关基因的基因集:LMx(与LM呈正相关的基因)、LMy(恶性细胞中上调的基因),取交集得到LMn。计算LM1-LM40的单个基因的Spearman相关系数(R)的几何平均值,超过0.25的基因收集到LM SIG中,共有84个基因(图2E)。基于Reactome(图2F)、GO(图2G)和KEGG(图2H)对这84个基因注释,结果表明,LM. SIG主要富含乳酸代谢相关和致瘤途径,如烟酰胺腺嘌呤二核苷酸(NADH)相关途径、三羧酸(TCA)循环相关途径和TP53调节,有几个基因被报道与免疫活性相关,如C1QBP、TUFM、LDHA、LDHB和ACAT1。
3、基于泛癌TCGA队列的LM. SIG免疫图谱
在基因层面,作者比较了LM.SIG与不同癌症类型免疫相关基因表达水平之间的相关性,LM.SIG评分与这些基因的表达之间存在显著负相关(图3A)。细胞层面,高LM.SIG评分的肿瘤减少了抗肿瘤免疫细胞的浸润,包括NK细胞和细胞毒性淋巴细胞(图3B)。在通路上,高LM. SIG评分的患者中排名靠前的通路有氧化磷酸化、活性氧途径、DNA修复和MYC靶向通路等(图3C)。因此,获得较低LM.SIG的患者往往比获得较高LM.SIG的患者获得更好的抗肿瘤免疫。
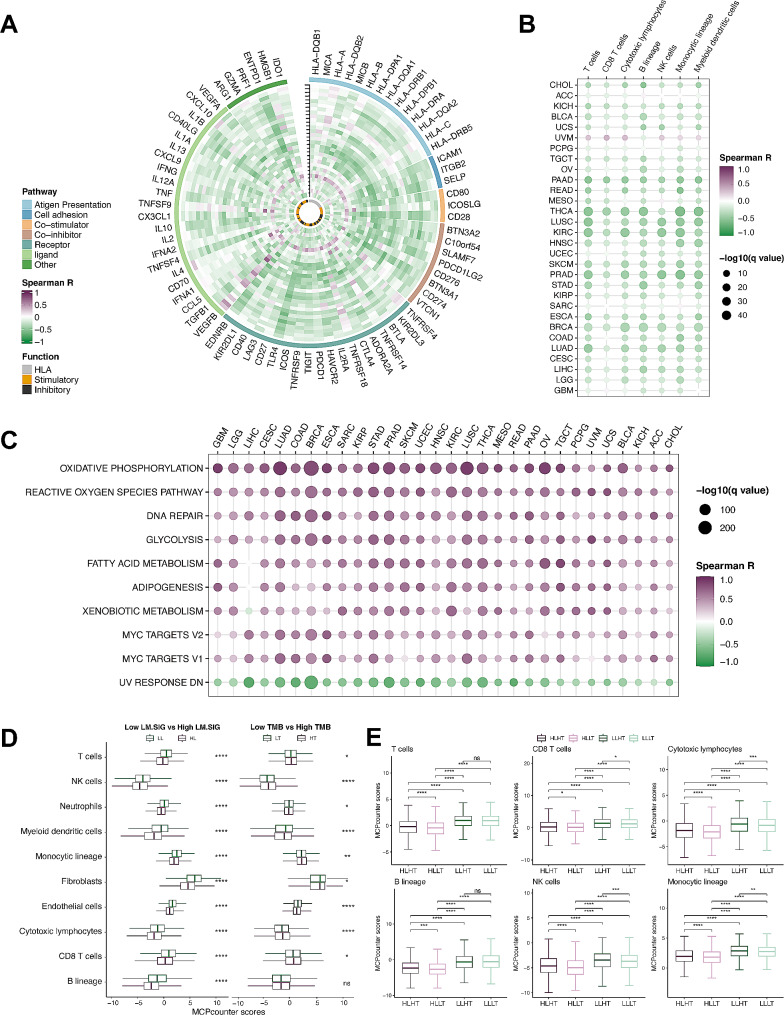

图3
4、LM.SIG的免疫治疗反应预测
将8个临床信息完整的免疫治疗数据集,分类为训练集(n=618)、验证集(n=154)和测试集(n=79)(图4A)。使用7种机器学习算法训练模型,并迭代10次重复5倍交叉验证,计算AUC值,确定best的LM.SIG模型(图4B-C)。随后进行了一系列测试,证明了LM.SIG在预测泛癌数据集中免疫治疗反应的能力。
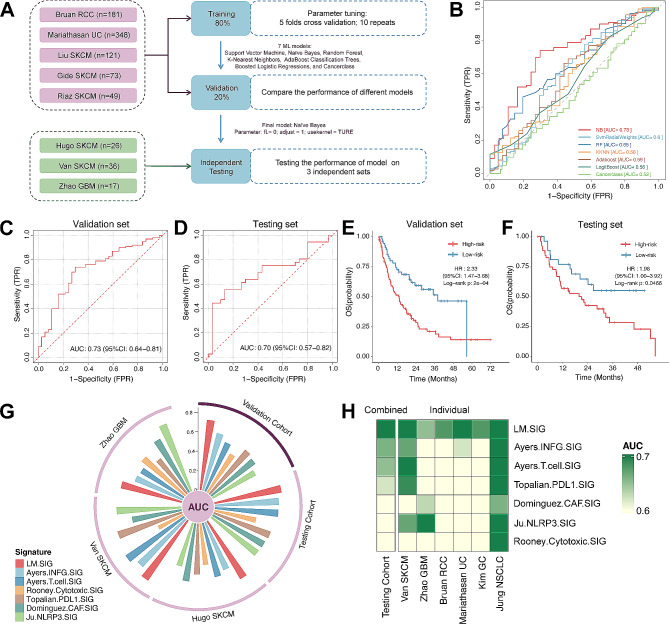

图4
5、LM.SIG 的生存预测
为了调整LM.SIG对泛癌生存率的预测,作者开发了一种基于SurvBenchmark设计的生存模型。评估了各种生存特异性模型,利用TCGA泛癌患者数据集训练LM.SIG预后模型,MTLR_GA并被确定为best模型(图5A)。
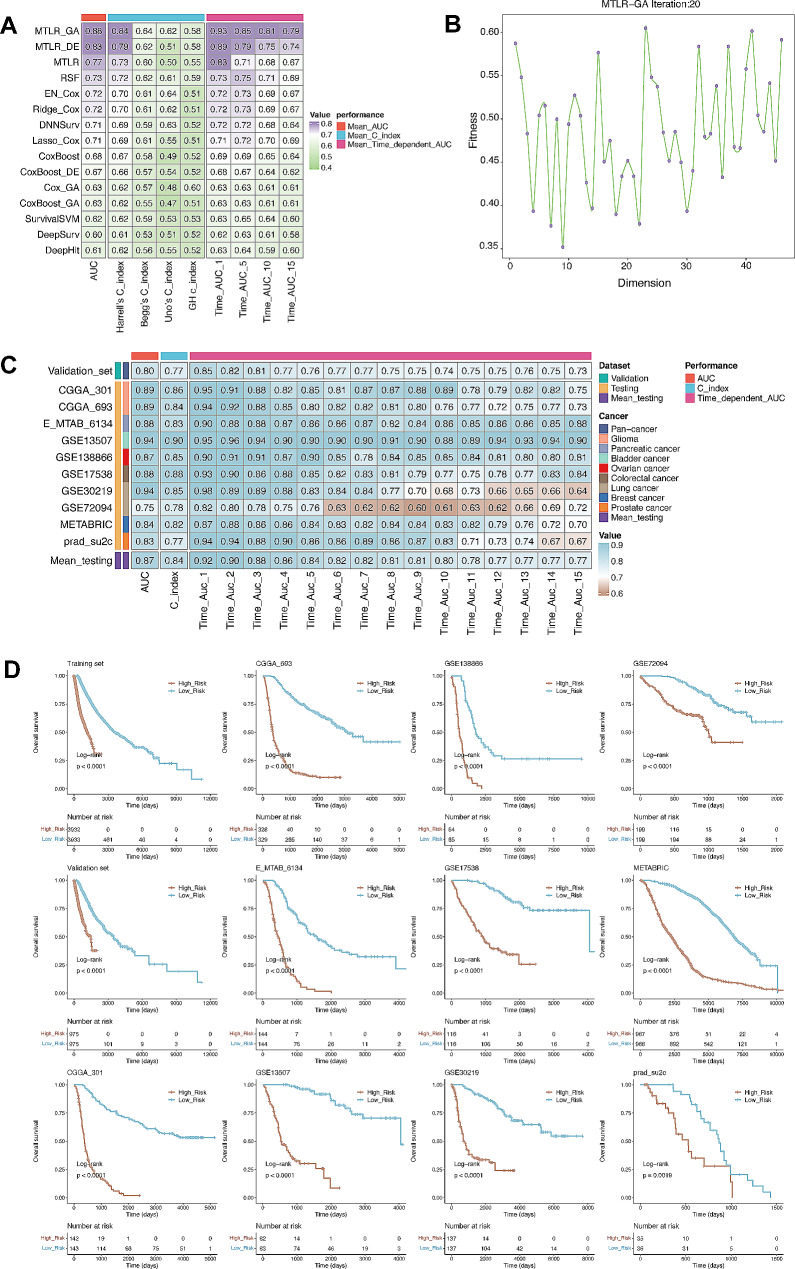

图5
6、使用CRISPR研究从LM. SIG产生的潜在治疗靶点
从7项CRISPR研究中提取17个CRISPR数据集,CRISPR基因中z评分排名靠前的基因被视为免疫抵抗基因(图6A)。LM.SIG占排名靠前的基因的比例高于其他特征(图6B-C)。为了进一步研究具有免疫治疗预测和生存预测的靶点,将19个CRISPR集中的基因和10个LM. SIG预后模型相关的基因取交集,得到靶点基因LDHA(图6D)。LDHA基因的显著性也在TCGA泛癌数据集和3个队列数据集中得到验证(图6E-G)。
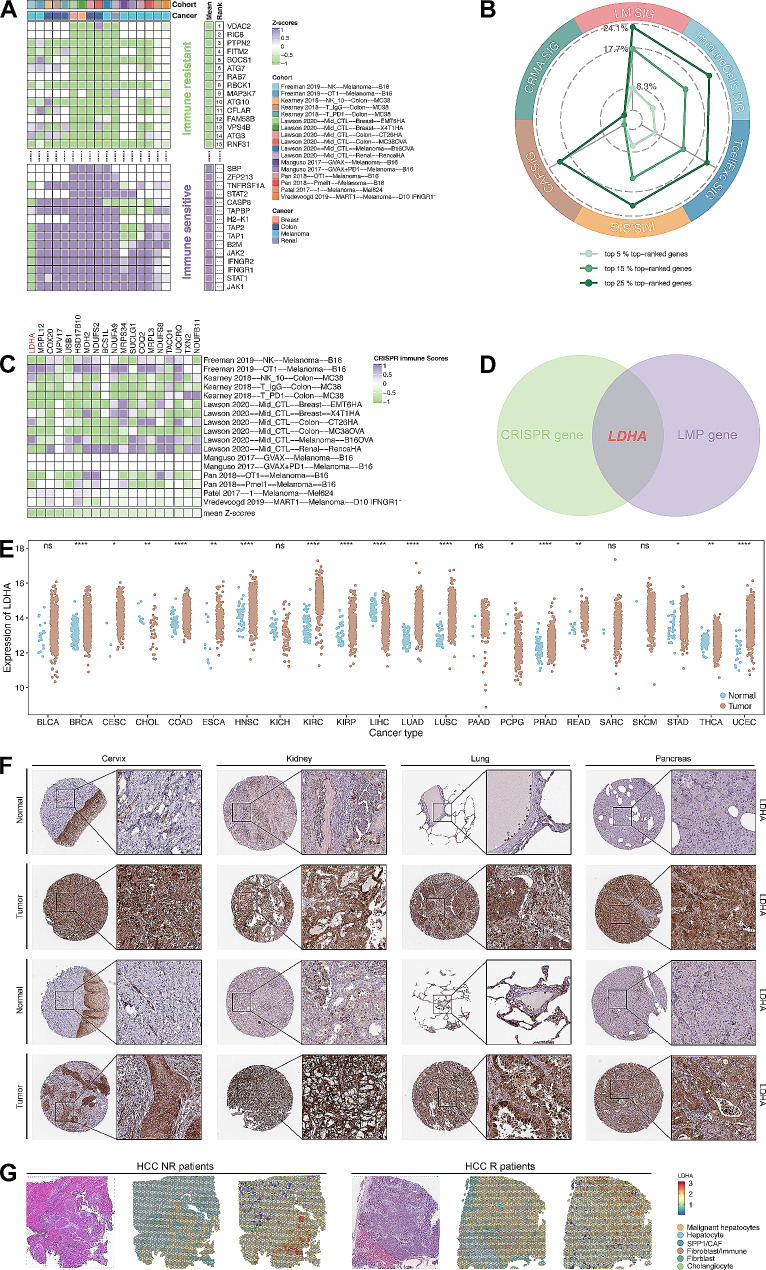
图 6
7、LDHA缺乏增强胰腺癌的抗肿瘤免疫和免疫治疗反应
从患者外周血中分离CD8+T细胞和CD14+单核巨噬细胞,体外M-CSF激活并与sh-NC 或 sh-LDHA胰腺癌类器官共培养(图7A)。显微镜观察和细胞活力检测显示,LDHA的敲除显著地减慢了类器官的生长速度(图7B)。通过IHC染色,在sh-LDHA 类器官中也观察到Ki-67的低表达(图7C)。同时,分析共培养系统中的CD8+T细胞和巨噬细胞。RT-qPCR结果显示,共培养时,T细胞杀伤基因和免疫检查点基因(IFNG、GZMB、PDCD1和CTLA4)的表达显著升高,而巨噬细胞M2相关标志物(CD206、CD163、TGFB和ARG1)的表达降低,M1相关标志物(IL1A、IL1B和CD80)的表达增加(图7D)。这些结果表明sh-LDHA 的类器官中巨噬细胞从原瘤转向抗肿瘤。此外,流式细胞术分析显示sh-LDHA组的CD8+T细胞具有更强的抗肿瘤活性和增殖能力(图7E-G),巨噬细胞更倾向于抗肿瘤M1极化(图7H-K)。用KPC细胞(sh-NC和sh-LDHA)注射到小鼠的腹部外侧产生皮下肿瘤,并在第9、12和15天腹腔注射抗IgG或抗PD1(图7L)。与sh-NC组相比,sh-LDHA组抗PD1治疗效果更显著,肿瘤减少更明显(图7M,N)。IHC结果还表明,sh-LDHA的肿瘤具有丰富的免疫细胞浸润和较慢的肿瘤增殖(图7O)。实验结果表明,LDHA影响免疫细胞的状态,低表达的LDHA提高了它们在胰腺癌免疫治疗中的疗效。

 图 7
图 7




