IF6.7/Q1,代谢组+网络药理学揭示黄芪皂苷IV对酒精性肝病的保护作用!
题目:代谢组学结合网络药理学揭示黄芪皂苷IV对酒精性肝病的保护作用
英文名:Metabolomics combined with network pharmacology reveals the protective effect of astragaloside IV on alcoholic liver disease
杂志:Phytomedicine
影响因子:6.7/Q1
发表时间:2024年9月
研究背景:酒精性肝病(ALD)是造成肝损伤的重要因素。然而,治疗ALD的临床方案却很有限。黄芪皂苷IV(AST-IV)是从黄芪(AM)中分离出来的一种皂苷。本研究旨在通过整合代谢组学和网络药理学,探索AST-IV在ALD中的潜在作用机制。
研究思路:用Sprague-Dawley(SD)大鼠建立ALD大鼠模型,开展实验评价AST-IV对ALD的保肝作用。测量了大鼠的体重、肝脏指数、ALT、AST、TC、TG、炎症指标(IL-1β、IL-6和TNF-α)和氧化应激标记物(SOD、MDA),并使用H&E和ORO染色来评估AST-IV和MDA的保肝效果,初步了解AST-IV在ALD中的潜在作用。随后,进行了非靶向代谢组学研究,预测AST-IV对ALD大鼠脂质代谢的影响。代谢组学可以全面地分析生物体内代谢物的变化,从而揭示药物对机体代谢的调节作用。然后,采用网络药理学方法确定了AST-IV矫正脂质代谢紊乱的核心靶点,并通过分子对接、qRT-PCR和Western Blot分析验证了这些靶点。最后,利用斯皮尔曼相关分析法计算了ALD相关生化指标、不同肝脏代谢物和核心靶点之间的关系,结果表明AST-IV可改善肝癌大鼠肝细胞的病理损伤并减少脂质积累,研究流程见图1。
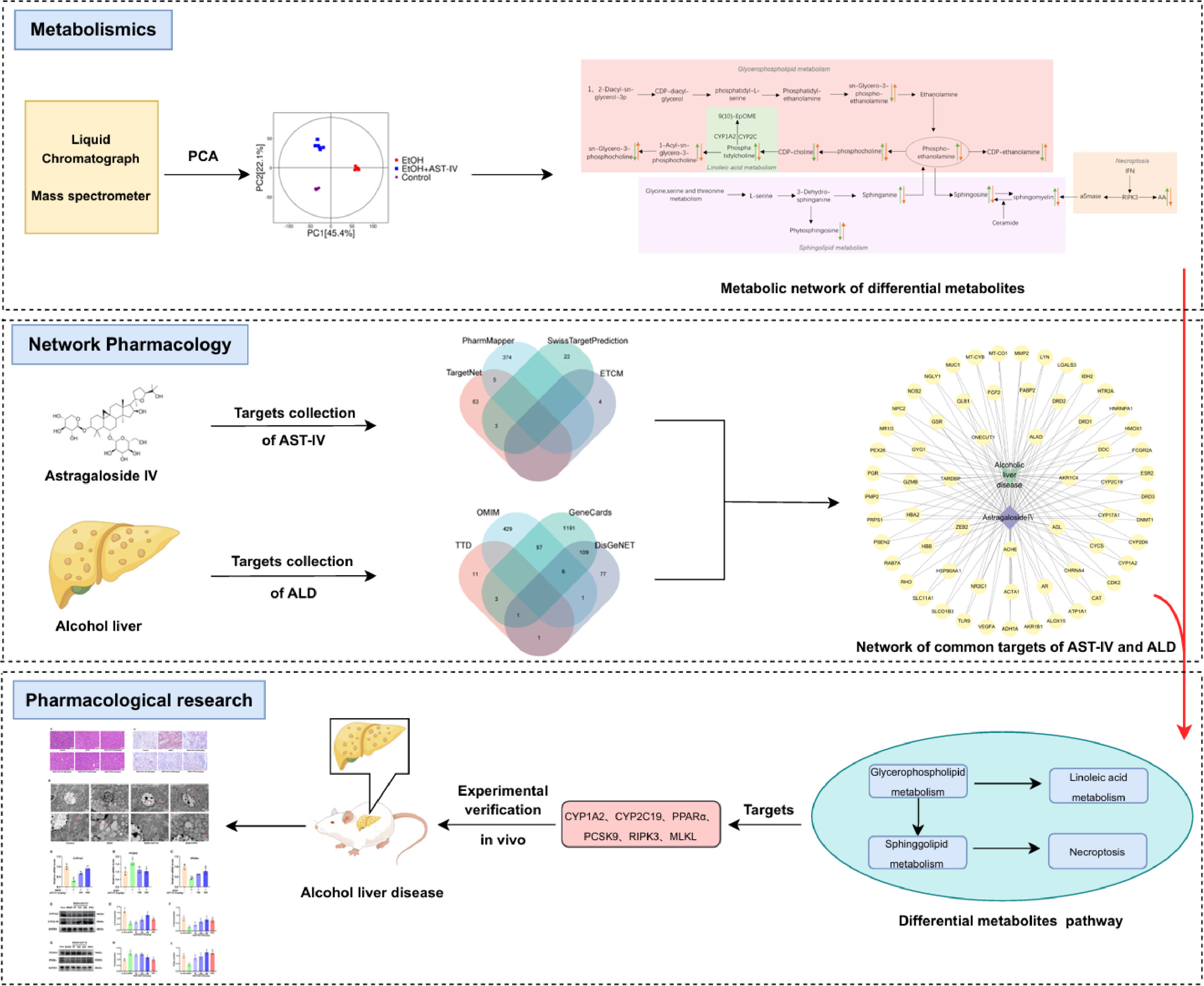

图1
研究结果:
1、AST-IV可改善乙醇诱导的ALD大鼠肝损伤
在喂食乙醇的28天内,大鼠体重显著下降(图2A),喂食乙醇导致肝指数、血清谷草转氨酶和谷丙转氨酶水平显著升高,表明肝损伤严重,同时TG和TC水平升高,表明脂质代谢紊乱(图2B-F)。H&E和ORO染色法进一步证实了这一点,由于乙醇喂养,肝细胞中出现了不规则的肝索、空泡化以及脂质堆积现象(图2G和H)。此外,大鼠肝脏细胞核Nrf2、CAT蛋白和血清。SOD水平降低,细胞质Nrf2、Keap1、HO-1蛋白和血清MDA水平升高,表明乙醇诱导的氧化应激作用显著(图3A、B)。此外,炎症因子IL-1β、IL-6和TNF-α的水平随着ALD的进展而升高(图3C-E)。每天灌胃50、100或200毫克/千克AST-IV和10mg/kgPPC在肝脏组织学、脂质代谢、氧化应激和炎症方面显示出对乙醇诱导的肝损伤的有效保护(图2A-H、3A-E)。这些研究结果表明,AST-IV可改善乙醇诱导的大鼠肝损伤。
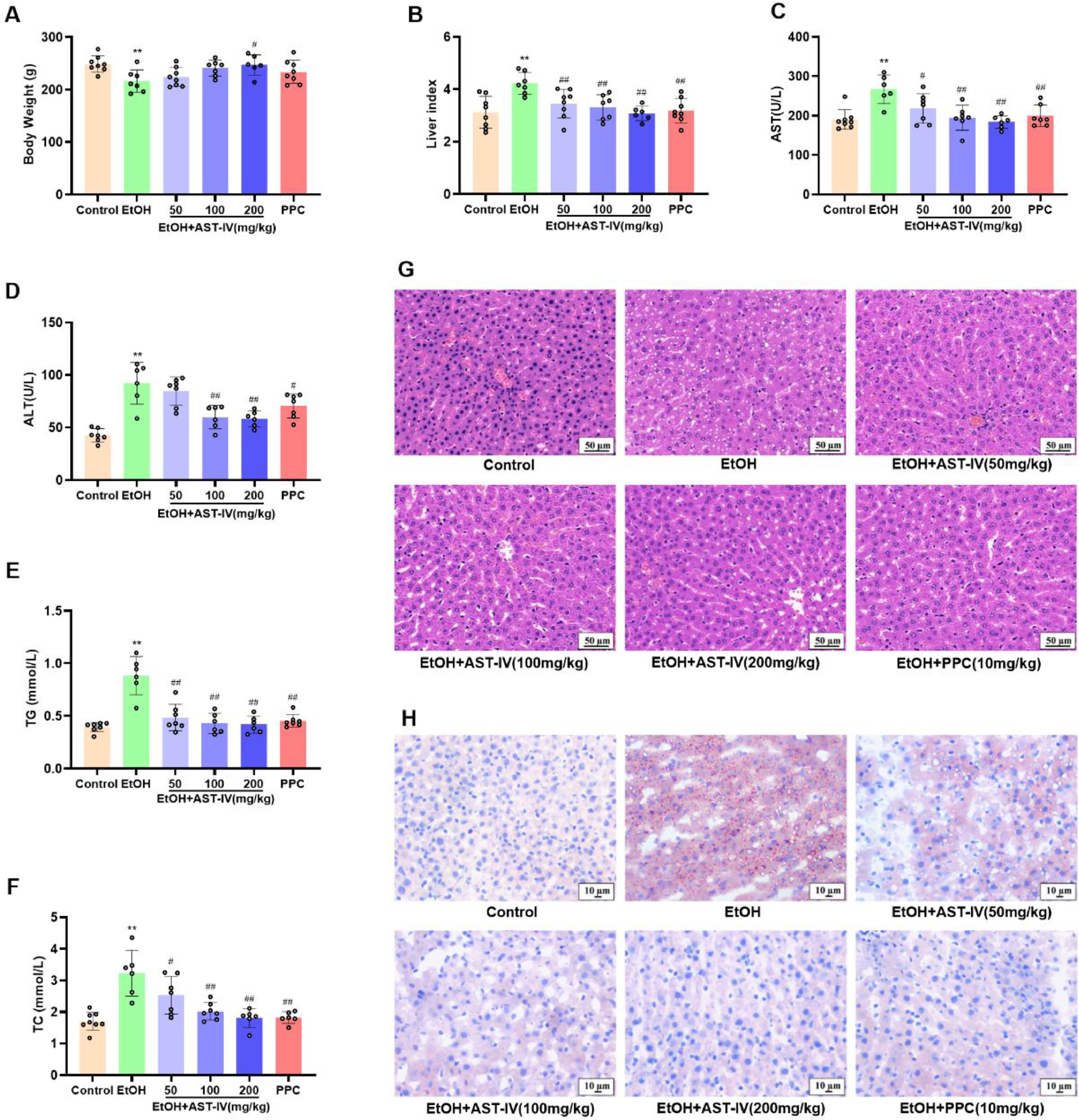

图2
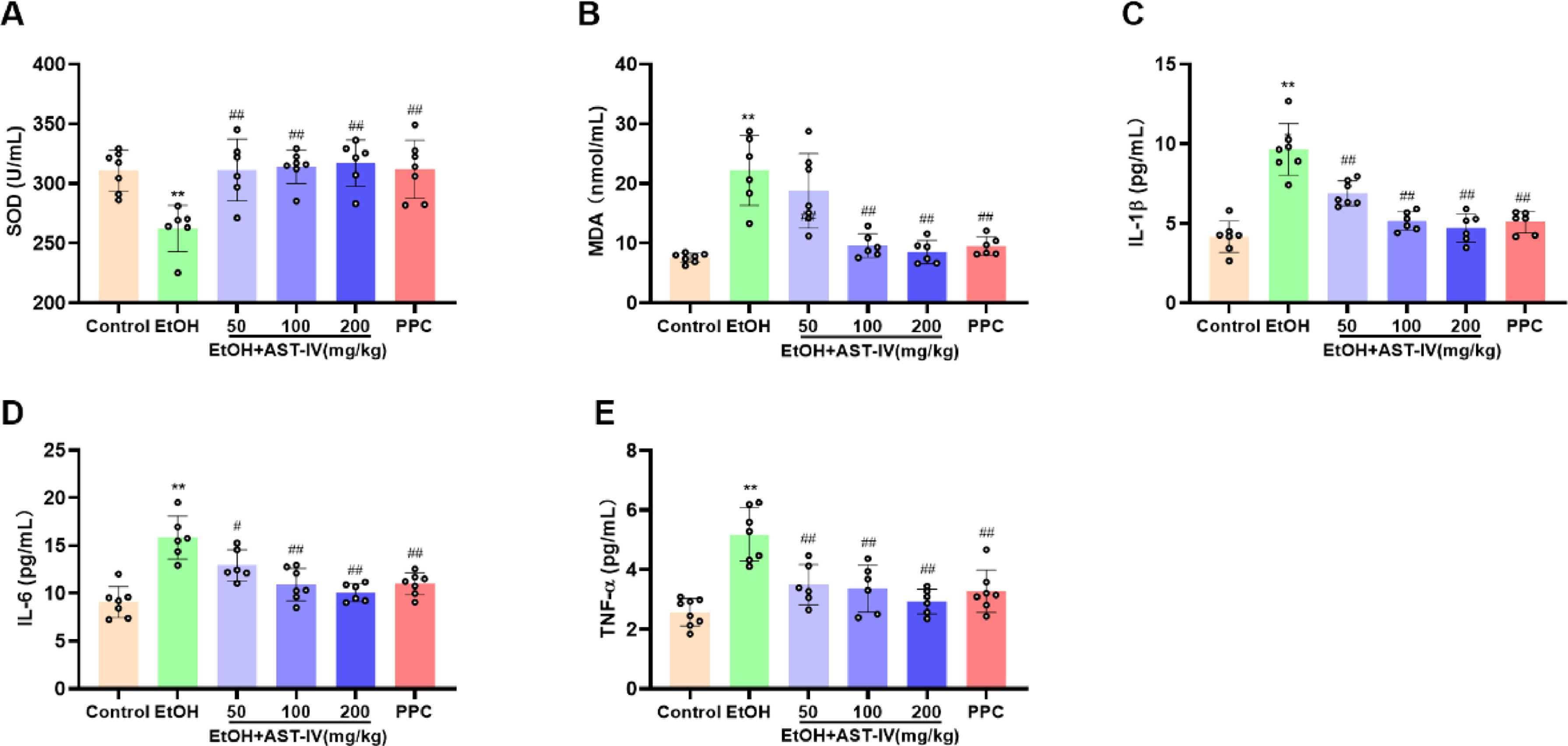
图3
2、AST-IV可纠正ALD大鼠肝脏脂质代谢紊乱的问题
在肝脏中,OPLS-DA图明确区分了对照组、EtOH组和EtOH+AST组(图4A和B)。此外,PCA评分图显示,代谢物在对照组和乙醇组之间,以及乙醇组和乙醇+AST-IV组之间有明显的差异(图4C)。这些发现表明,AST-IV可改善乙醇引起的肝脏代谢紊乱。使用OPLS-DA(VIP>1)和t检验(P<0.05)确定差异代谢物。对照组和EtOH组之间共发现811个差异代谢物(图4D),EtOH组和EtOH+AST-IV组之间共发现745个差异代谢物(图4E),对照组与EtOH组、EtOH组与EtOH+AST-IV组之间共发现544个重叠差异代谢物(图4F)。绘制了一张热图来显示三组重叠差异代谢物的强度水平(图5a)。图5B显示了重叠差异代谢物前15个通路的KEGG通路富集分析,突出显示了涉及精氨酸生物合成、淀粉和蔗糖代谢、坏死、核苷酸代谢、糖共磷脂酰肌醇(GPI)-锚生物合成、鞘脂代谢、甘油磷脂代谢以及牛磺酸和低牛磺酸代谢的通路。由于ALD以脂肪肝和肝细胞坏死为特征,脂质代谢、坏死途径和代谢物相应变化之间的联系见图5C。
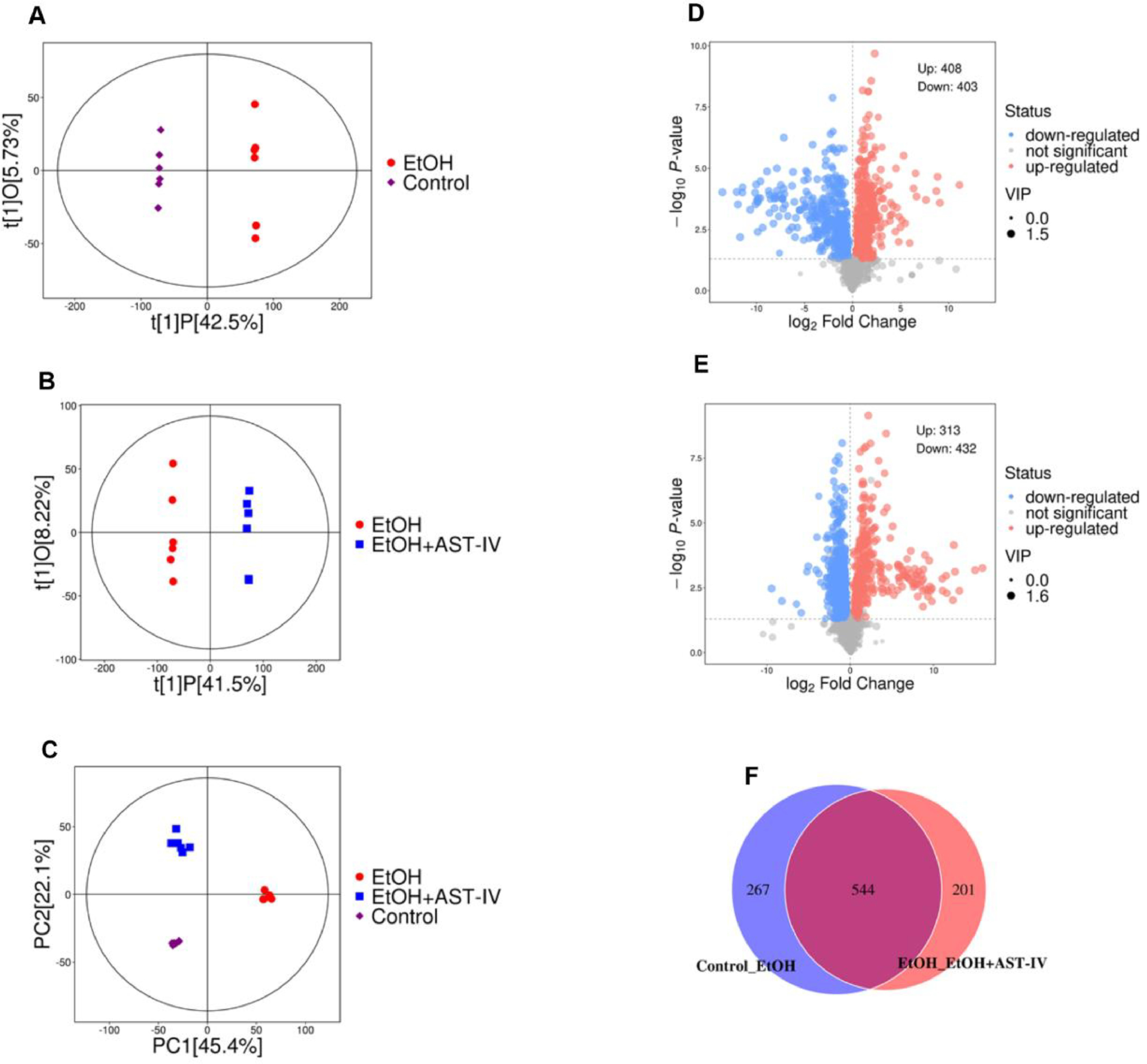
图4

图5
3、AST-IV通过作用于脂质代谢途径和靶点改善ALD
采用网络药理学方法,从蛋白质水平研究了AST-IV治疗ALD的机制。AST-IV靶点从四个数据库中获得,确定了235个AST-IV靶标。使用搜索词"酒精性肝病",检索肝病靶标通,发现了803个与ALD相关的基因。通过维恩图分析,确定了63个AST-IV和ALD的共同靶标(图6A)。利用Cytoscape(图6B)将AST-IV靶点和共同靶点可视化,随后,针对这些共同靶点构建了一个蛋白质-蛋白质相互作用(PPI)网络,显示了排名前十的靶点(图6C)。应用Cytoscape的七种算法、维恩对角线分析,最终确定了六个共同的中枢基因:CYP1A2、HMOX1、CYCS、HSP90AA1、MMP2和FGF2(图6D)。构建了一个由六个常见关键基因组成的蛋白质-蛋白质相互作用(PPI)网络(图6E)。然后对共同靶标进行KEGG富集分析,以确定AST-IV治疗ALD的潜在途径(图6F)。结果显示,AST-IV可能通过亚油酸代谢、药物代谢-细胞色素P450、过氧化物酶体和色氨酸代谢等途径对ALD起作用。
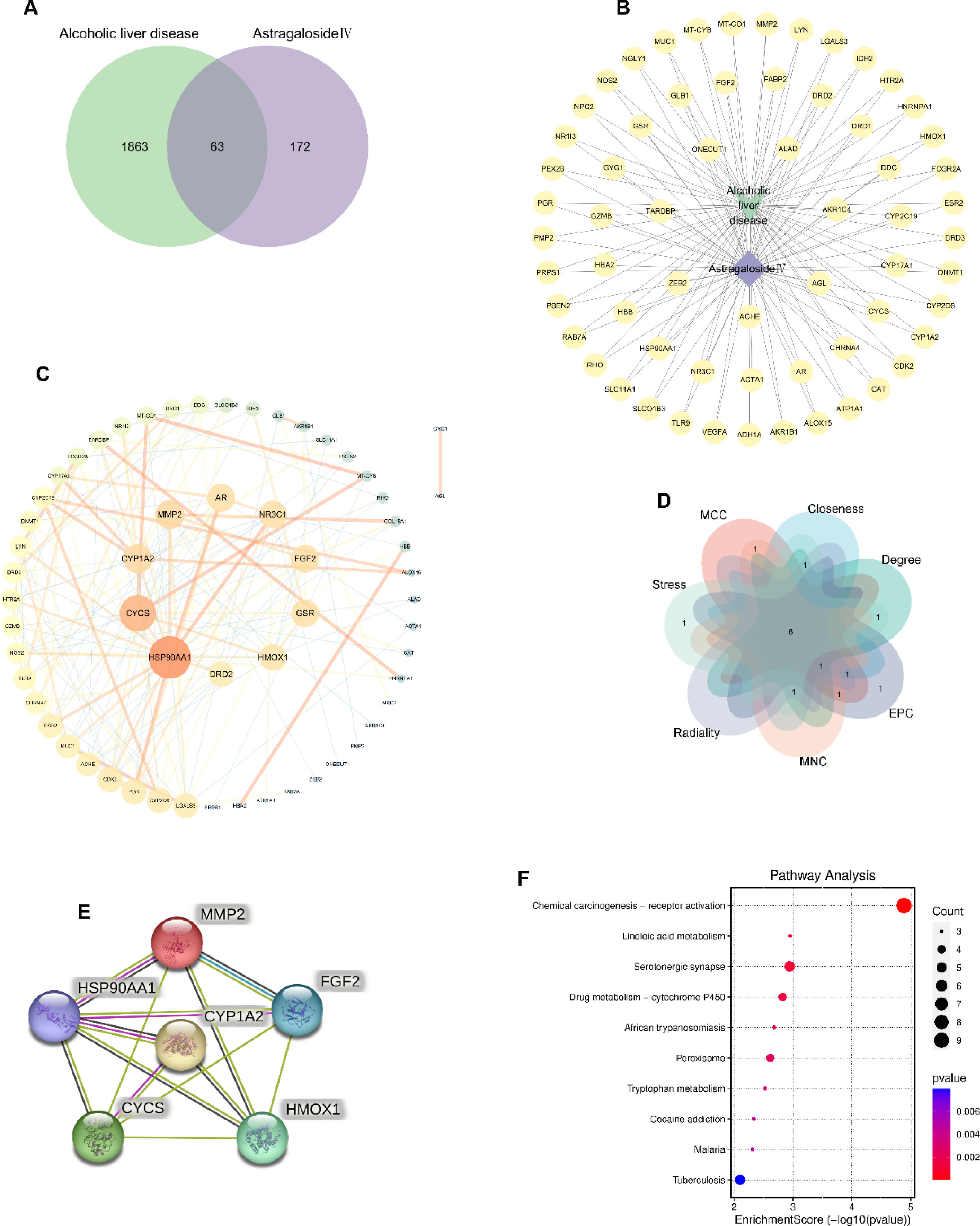
图6
4、AST-IV与核心蛋白的结合力很强
为了进一步验证AST-IV与ALD核心靶标的结合位点和结合能力,使用AutoDock进行了分子对接。RIPK3、MLKL、CYP1A2、CYP2C19、PPARα和PCSK9作为对接受体,AST-IV作为对接配体。对接结果使用PyMOL软件可视化(图7A-F)。结合能用于评估小分子与目标蛋白质之间相互作用的强度。结合能越低,表明复合物越稳定,结合活性越高。结合能显示,AST-IV与RIPK3、MLKL、CYP1A2、CYP2C19、PCSK9和PPARα有很强的结合力。
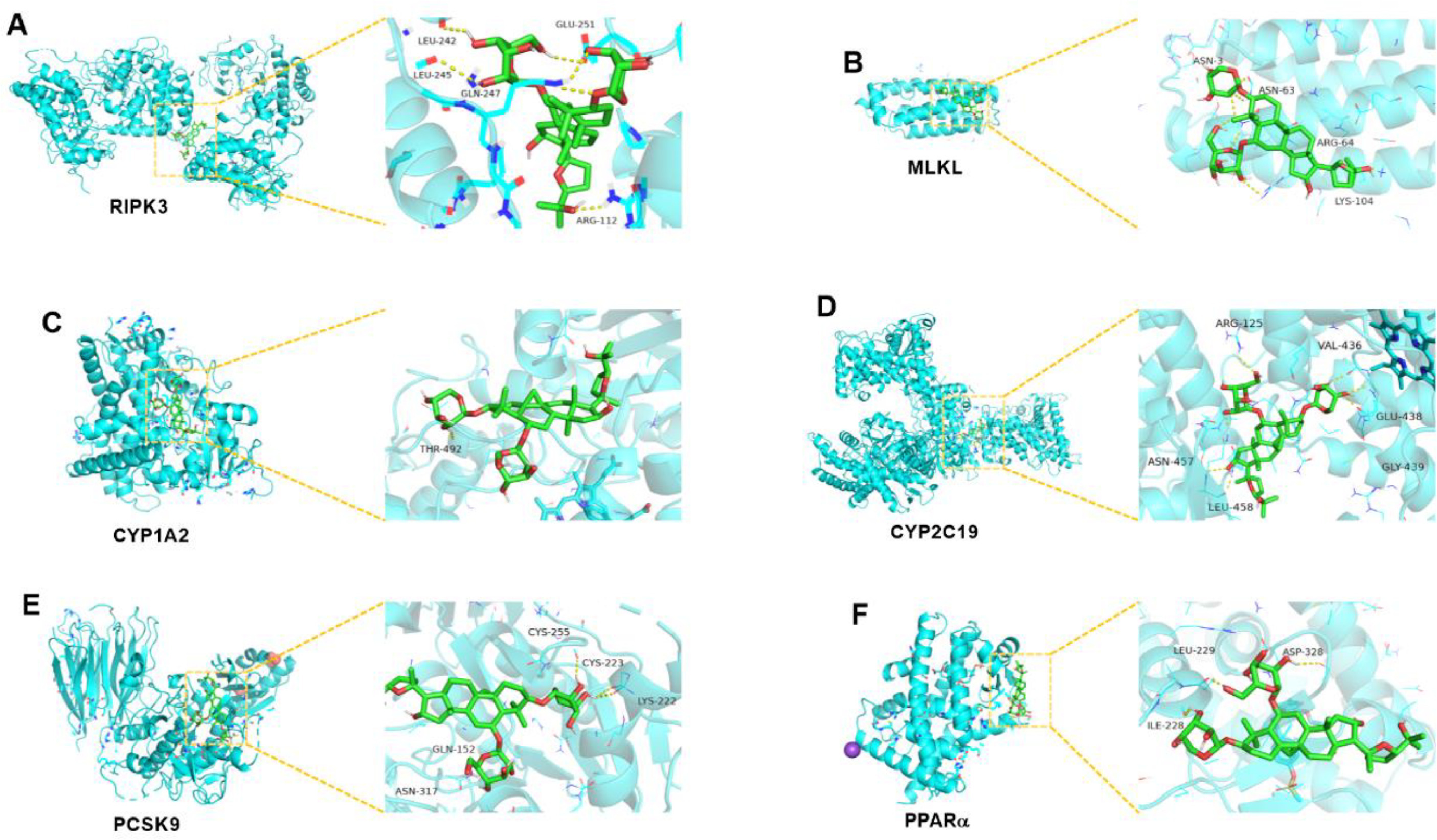
图7
5、AST-IV可减轻乙醇诱导的肝细胞坏死
乙醇引起的肝损伤通常以肝细胞坏死为特征。为了评估AST-IV对乙醇诱导的肝细胞坏死的保护作用,用电子显微镜观察了不同组大鼠的肝细胞。电子显微镜图显示,AST-IV可减轻乙醇诱导的肝细胞脂质堆积和线粒体肿胀(图8A)。此外,我们还评估了关键坏死相关蛋白的表达水平,包括p-RIPK3、RIPK3、p-MLKL和MLKL。Western印迹分析表明,乙醇组中p-MLKL和p-RIPK3的水平升高,而AST-IV可减少乙醇诱导的p-MLKL和p-RIPK3的表达(图8B-D)。总之,这些结果表明AST-IV可改善乙醇诱导的脂质积累和肝细胞坏死。
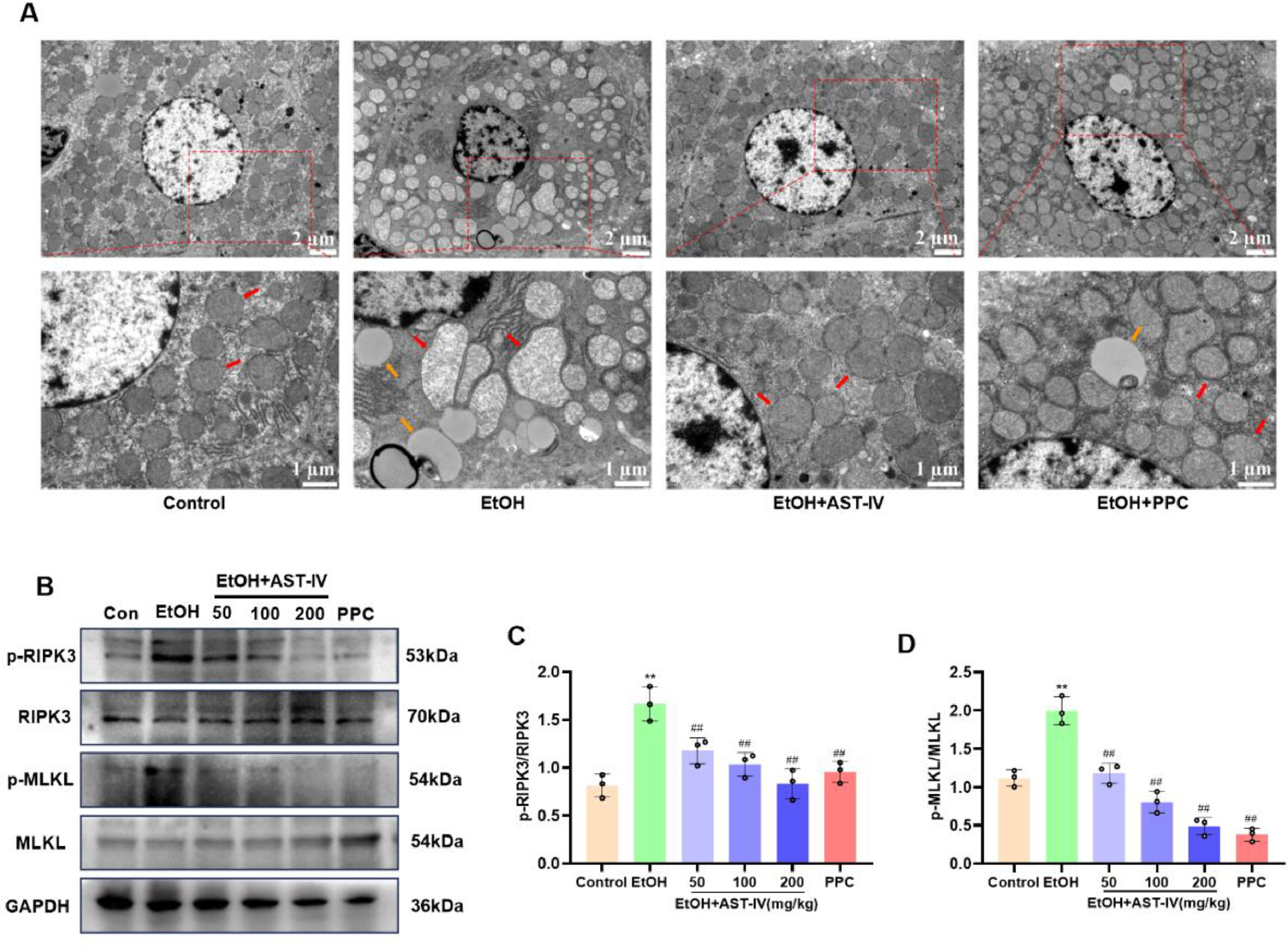
图8
6、核心目标的实验验证与预测结果一致
为了验证网络药理学和分子对接的结果,进行了qRT-PCR和Western印迹来评估核心蛋白的表达。ALD大鼠体内CYP1A2和CYP2C19的mRNA和蛋白水平显著下降,而AST-IV能够逆转这一过程(图9A,D-F)。此外,在EtOH组中,CYP1A2和CYP2C19的mRNA和蛋白质水平均明显下降(图9A,D-F)。与对照组相比,脂质代谢标志物PCSK9的mRNA和蛋白水平升高,PPARа的mRNA和蛋白水平降低。相比之下,AST-IV治疗可使这些mRNA和蛋白水平恢复到与对照组相似的水平(图9B、C、G-I)。这些研究结果表明,AST-IV能纠正乙醇引起的肝脏脂质代谢紊乱。实验验证结果与预测结果一致。实验验证结果与预测结果一致,表明AST-IV可通过靶向CYP1A2、CYP2C19、PSCK9和PPARα来缓解大鼠的ALD。


图9
7、与ALD相关的血清生化指标、核心靶标和肝脏差异代谢物具有相关性
为了进一步阐明AST-IV减轻ALD的机制,对ALD相关生化指标、核心靶点和肝脏差异代谢物进行了斯皮尔曼相关性分析(图10A)。为了直观地表示这些相关性,用关联构建了涉及ALD相关生化标志物、核心靶标和肝脏差异代谢物的网络(图10B)。总之,这些结果表明,AST-IV可通过抑制乙醇诱导的坏死和改善脂质代谢来减轻ALD。
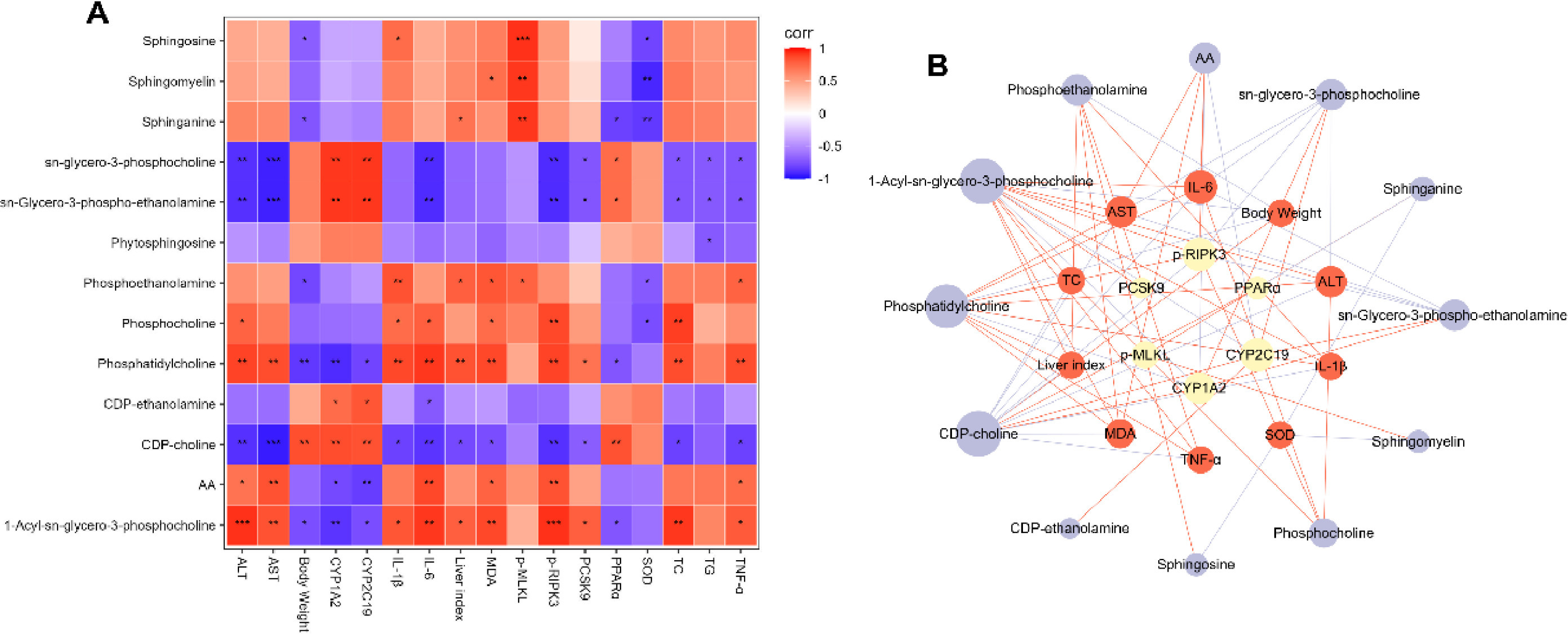

图10
总结:本文思路清晰,采用生信分析+实验验证相结合的研究方法,揭示了揭示黄芪皂苷IV对酒精性肝病的保护作用!傲星生物深耕生信分析十余载,有丰富的实验方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




