IF:14.3!网络毒理学+网络药理学,双剑合璧,登顶Advanced Science!
题目:α-硫辛酸通过促进鸡肝细胞中过氧化物酶体β-氧化和减少脂自噬来改善砷诱导的脂质紊乱
英文名:α-Lipoic Acid Ameliorates Arsenic-Induced Lipid Disorders by Promoting Peroxisomal β-Oxidation and Reducing Lipophagy in Chicken Hepatocyte
杂志:Advanced Science
影响因子:2025年1月30日
发表时间:14.3
研究背景:肝脏疾病对全球公共健康构成重大威胁,砷(As)被认为是导致肝损伤的主要环境毒素。α-硫辛酸(LA)通常被称为硫辛酸和1,2-二硫环戊烷-3-戊酸,是一种天然抗氧化剂,研究表明,LA 在体外和体内都能促进生长、增强抗氧化作用、调节脂质代谢、减轻毒素的影响、提高免疫力、抑制细胞凋亡、降低内质网应激和抑制脂质沉积。然而,α-硫辛酸(LA)的具体机制和保护作用仍不清楚。
研究思路:本研究利用网络毒理学和网络药理学全面分析了As的肝毒性机制和LA的保肝机制,并进一步验证了这一过程中过氧化物酶体β氧化和噬脂作用的机制。网络分析结果表明,As主要通过自噬、细胞凋亡、脂质代谢和氧化应激诱导肝损伤,而LA主要通过调节脂质代谢发挥保肝作用。进一步验证发现,As抑制SIRT1的表达,激活P53和Notch通路,损伤线粒体,抑制过氧物酶体β氧化,增加脂质积累,增强肝脏的脂吞噬功能;而LA通过靶向SIRT1,改善线粒体损伤,增强过氧物酶体β氧化,从而减轻As诱导的肝损伤,减轻As诱导的脂质积累,增强脂吞噬功能。这项研究进一步阐明了As肝毒性的机理,为LA作为一种潜在的保肝药物提供了理论依据。
研究结果:
1、对砷诱发肝损伤潜在机制的网络毒理学分析
通过CTD、GeneCards数据库,筛选出754个与As相关的靶基因和1410个与肝损伤相关的靶基因(图1A)。GO、KEGG富集分析显示,As主要通过调节自噬、凋亡、脂质代谢和氧化应激等相关通路,影响肝细胞的氧化应激、增殖、分化、凋亡、自噬、脂质代谢和炎症等生物学过程,从而诱发肝损伤(图1B-D)。
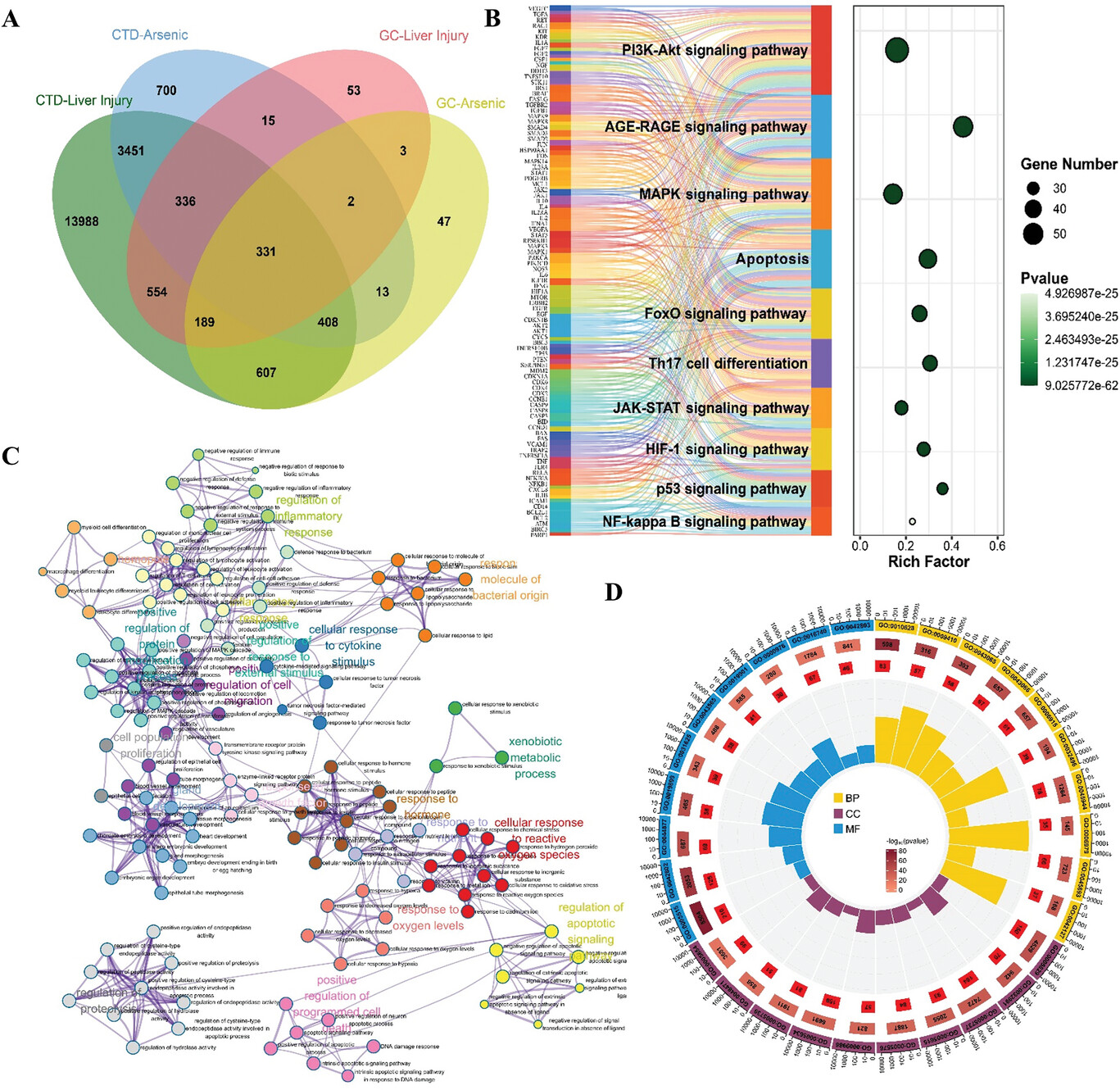
图1
2、LA改善了砷诱发的肝脏结构和功能损伤
根据网络毒理学分析和文献综述,发现LA的生物功能与As的肝毒性机制有明显重叠。结果表明,经过20周的治疗,As导致鸡体重下降,肝脏中天门冬氨酸氨基转移酶(AST)含量升高,而与As组相比,400mgkg −1 LA干预可增加鸡体重,降低肝脏中AST含量(图2A,C)。与20周的结果不同,As和LA在治疗32周后对体重和器官系数没有显著影响。然而,As明显升高了肝脏中的谷草转氨酶(AST)和丙氨酸氨基转移酶(ALT)水平,LA的干预明显缓解了这些升高(图2A-D)。此外,病理学和形态学观察显示,暴露于As20周和32周后,肝脏颜色变浅,肝索排列紊乱,脂滴增多,肝细胞核溶解和坏死加剧(图2E,F)。然而,LA干预可有效改善上述砷诱导的病理和形态学改变,其中400mgkg −1 LA具有更明显的保护作用(图2E,F)。
图2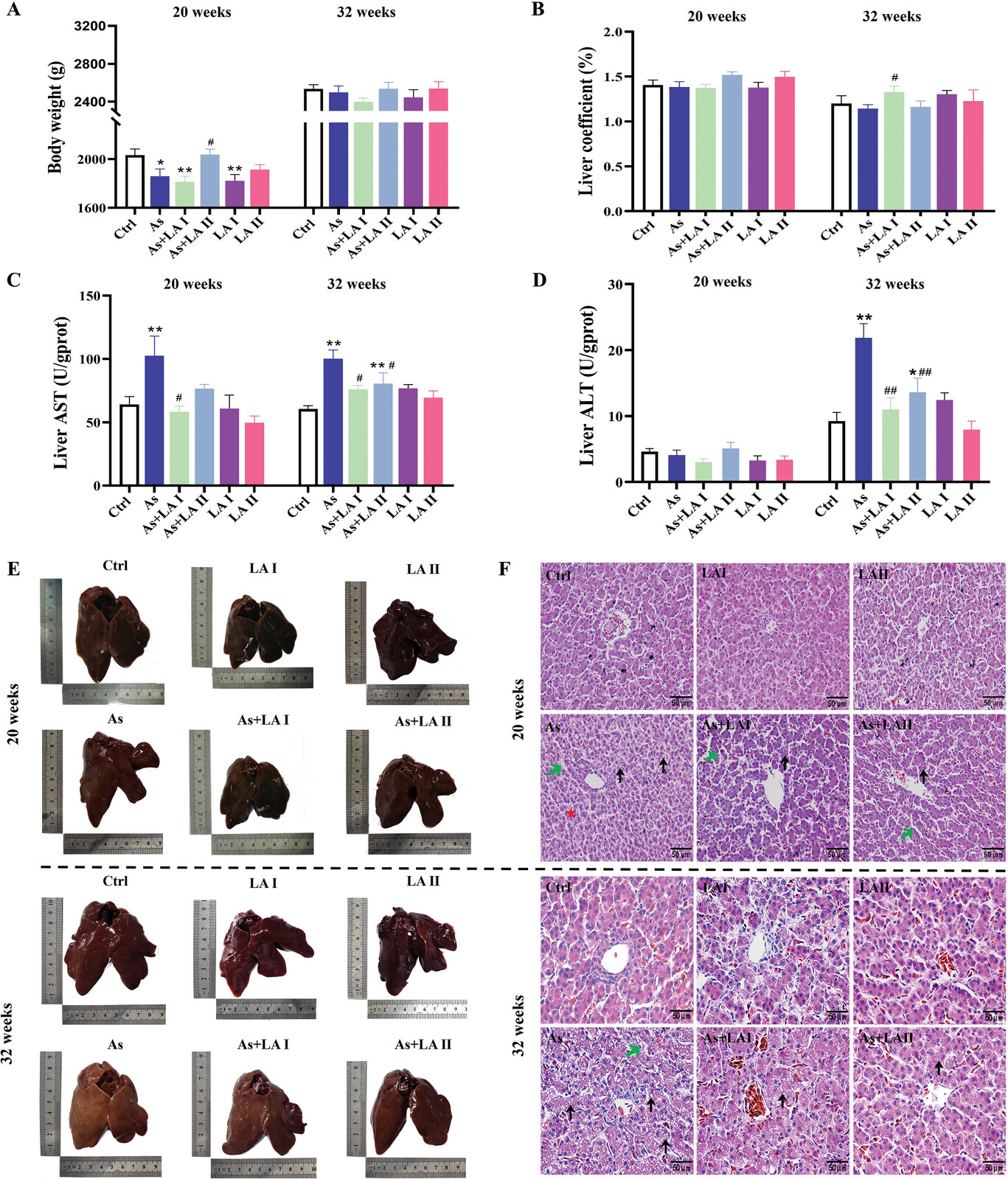
3、LA潜在保肝机制的网络药理学分析
为了进一步研究LA的潜在保肝作用,采用了网络药理学方法来鉴定和分析与LA相关的关键靶基因和生物学特征。在SwissTargetPrediction和TargetNet数据库中筛选出125个与LA相关概率大于0的潜在靶基因(图3A)。此外,GO富集分析结果显示,LA主要作用于脂质代谢相关的术语,其中与不饱和脂肪酸代谢过程和脂质储存负调控关系最为密切,分别占20.23%和19.21%(图3B-D)。此外,脂质代谢相关靶基因的KEGG富集分析显示,它主要与PPAR信号通路、P53信号通路、Notch信号通路、脂肪分解调控和鞘脂信号通路等通路有关(图3E)。此外,分析还发现SIRT1是LA的一个关键靶点,分子对接结果表明SIRT1蛋白有多个结合口袋,能以较低的结合能与LA稳定结合(图3F,G)。
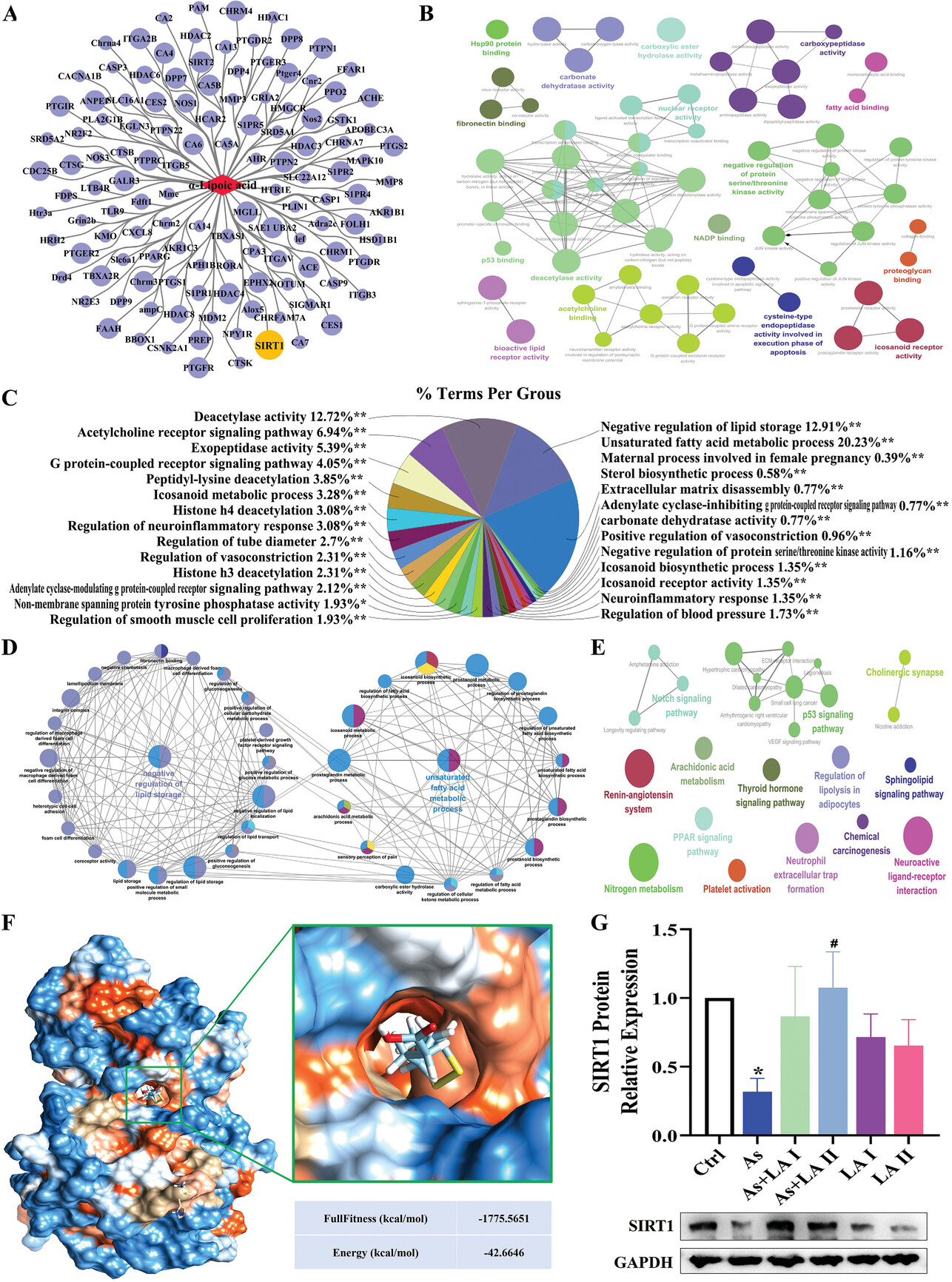
图3
4、LA可改善砷诱发的肝脂代谢紊乱
为进一步验证As的肝毒性机制和LA的保肝机制,本研究采用油红O染色、脂质代谢相关指标检测、RT-PCR和Western印迹法评估As和/或LA对肝脏脂质代谢的影响。结果表明,As暴露20周和32周后,会明显促进肝脏中总胆固醇(TG)、总胆固醇(T-CHO)和低密度脂蛋白(LDL)的积累,并降低高密度脂蛋白(HDL)的水平(图4A-D)。与脂质检测结果一致,油红O染色结果显示,治疗20周和32周后,肝脏中脂质(红色阳性区域)含量和脂滴数量增加,而LA干预可显著降低肝脏脂质含量(图4F)。油红O染色和肝脏As含量的统计分析显示,As暴露后红色阳性面积和肝脏As含量均显著升高,而LA的干预能有效缓解这些变化(图4E、G)。对关键基因的进一步检测发现,As暴露会显著升高肝脏中P53和Notch1的蛋白表达水平,而LA干预能有效降低这两种蛋白的表达(图4H,I)。这些结果表明,LA,尤其是400mgkg −1 ,对缓解As暴露诱导的肝脏脂质代谢紊乱有一定的作用,而这种紊乱是由P53和Notch通路调控的。
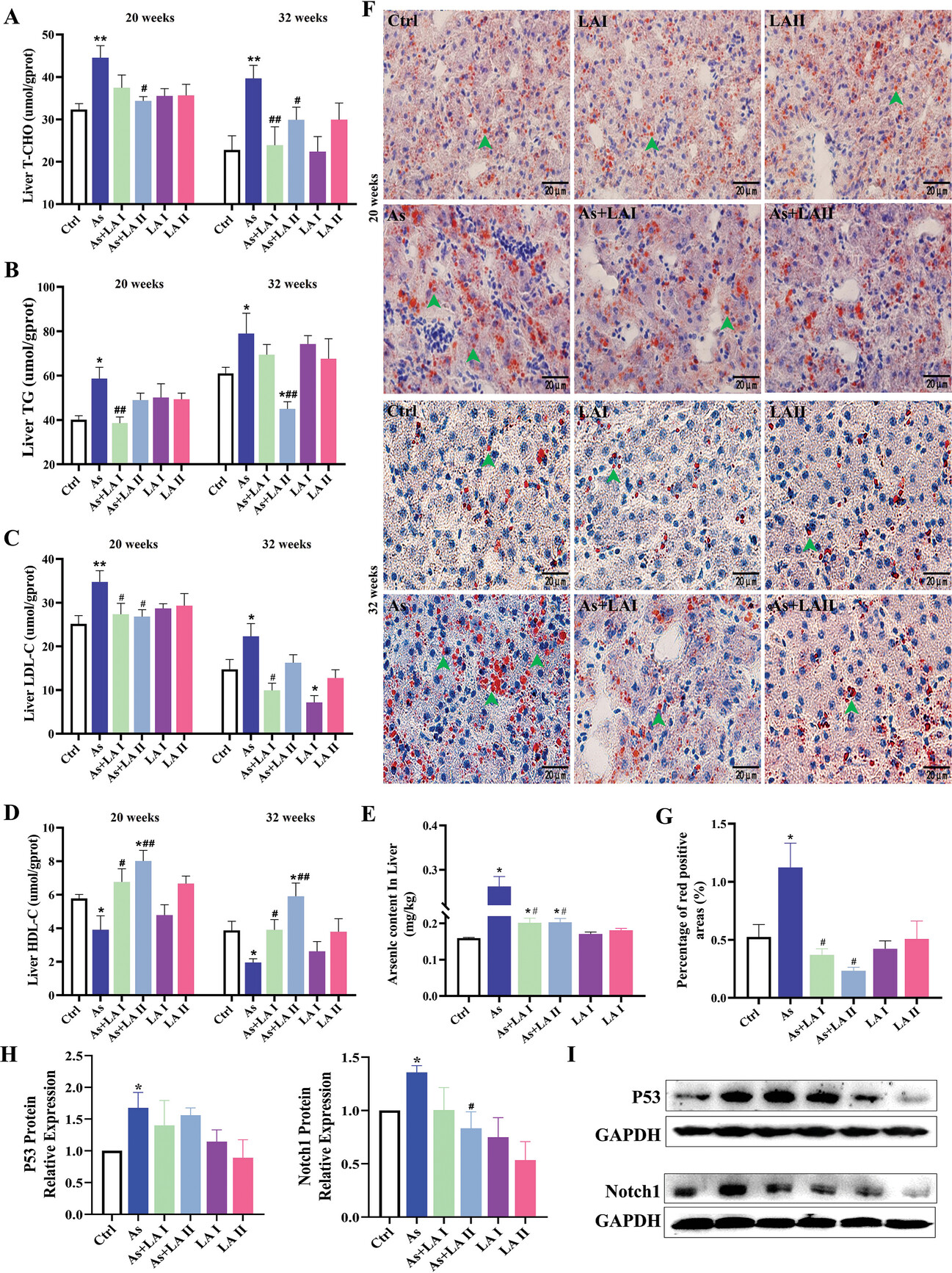
图4
5、LA可减轻As对肝脏过氧物酶体β氧化的抑制作用
用LA干预后,ATGL、LIPA和ACOX1的mRNA表达水平显著增加,而ACACA、FASN和CPT2的mRNA表达水平则大大低于As组(图5a)。与mRNA检测结果一致,ATGL和ACOX1的蛋白表达水平在As组明显降低,但在LA干预后明显升高(图5B,C)。线粒体和过氧化物酶体β氧化是脂质分解的核心生物过程。检测结果表明,As处理明显降低了乙酰-CoA和mtDNA的含量,而添加LA则有效抵消了这种降低(图5D,E)。此外,As明显降低了肝脏中乙酰-CoA合成关键基因(ACSS2和ACLY)的mRNA表达水平,而LA的干预则显著上调了ACSS2和ACLY的mRNA表达(图5F)。此外,如图5G所示,LA的干预显著降低了As诱导的PMP70(过氧化物酶体表面受体)和PLIN2(脂滴表面受体)蛋白表达水平的升高。使用PMP70标记过氧物酶体的进一步免疫荧光染色显示,As处理增加了肝脏中的过氧物酶体,而LA的干预则有效逆转了这一变化(图5H),这表明过氧物酶体β氧化参与了LA缓解As诱导的脂质沉积的过程。
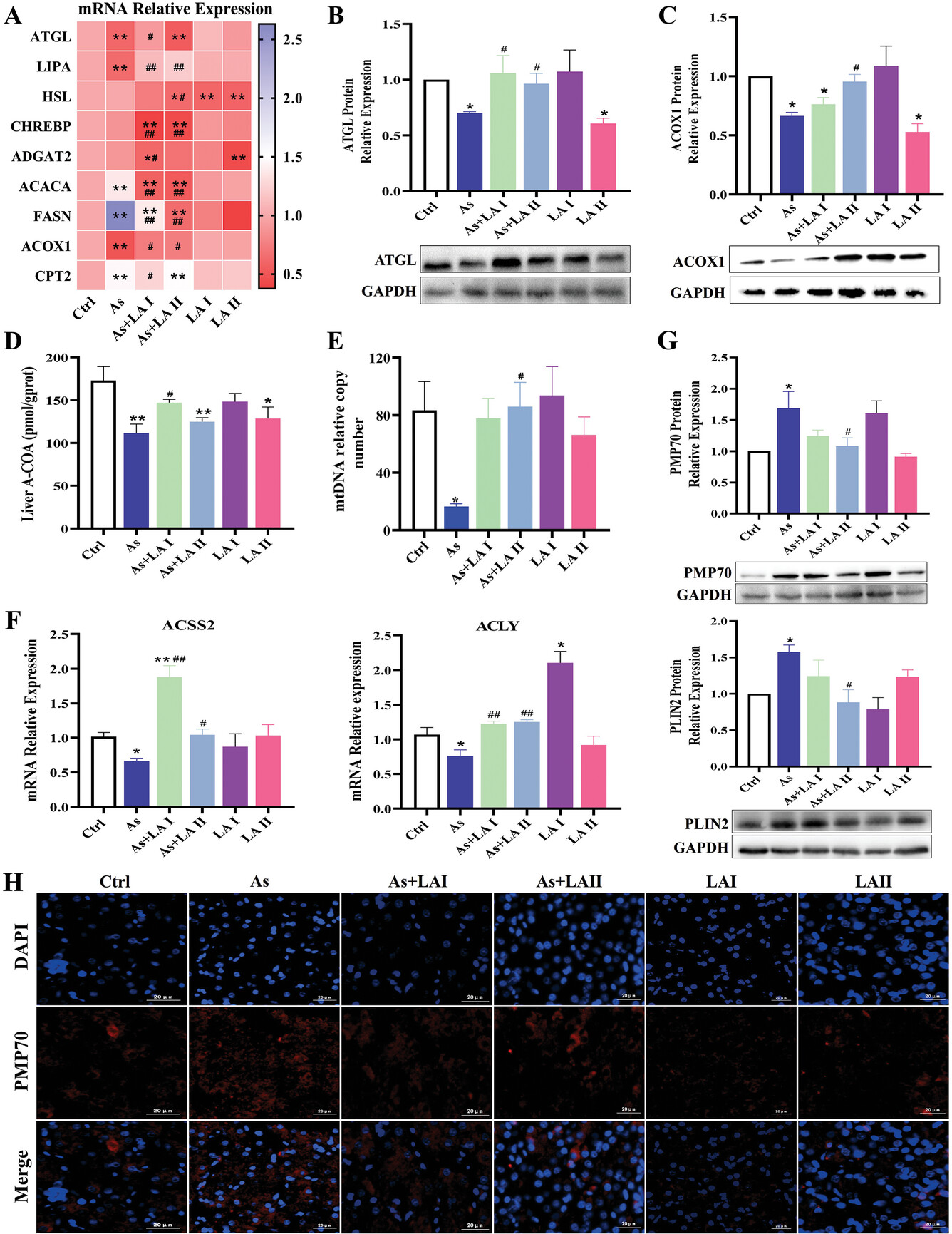
图5
6、LA可降低As诱导的肝细胞嗜脂性
采用免疫荧光染色、RT-PCR和Western印迹技术来进一步探讨噬脂在LA介导的改善As引起的肝脏脂质沉积中的作用。如图6A所示,与Ctrl组相比,As组噬脂体的荧光强度增强,表明噬脂体增加。与Ctrl组相比,As组LC3的mRNA表达显著增加,P62的mRNA表达显著减少(图6B)。As组LC3和P62的蛋白表达量显著增加,而LA干预组LC3和P62的蛋白表达量低于As组,与Ctrl组相比无显著差异(图6C,D)。上述结果表明,As暴露通过增加噬脂性诱导肝细胞损伤,而LA可减少噬脂性,减轻肝细胞损伤。
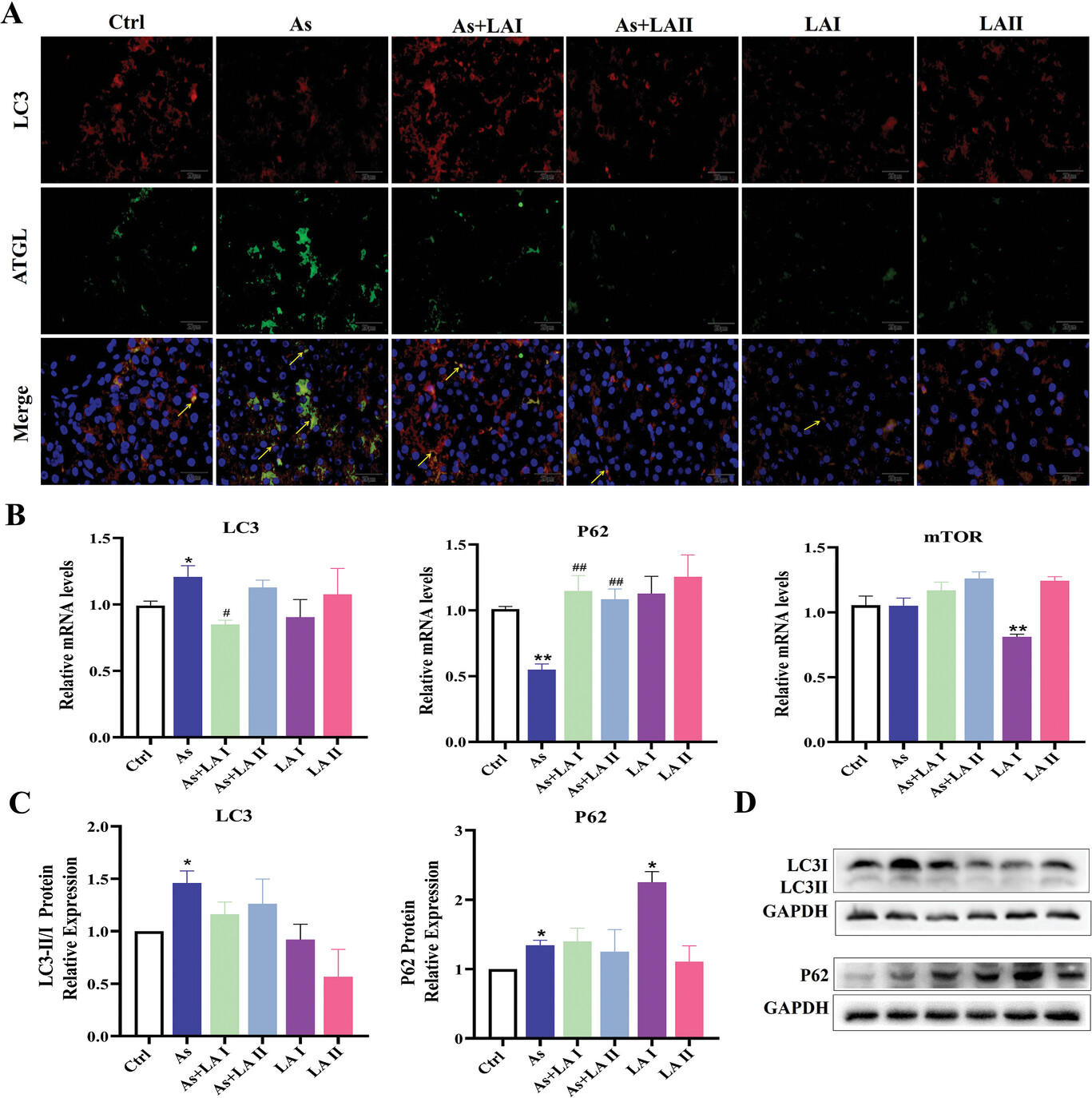
图6
7、LA可改善砷诱导的肝细胞损伤和脂质代谢紊乱,TRCDA可抑制体外过氧化物酶体β氧化作用
如图7A和B所示,随着As浓度的增加和处理时间的延长,肝细胞的增殖率明显下降。此外,随着LA浓度的增加,细胞的增殖率也相应降低。然而,25、50、75和100µmLA的干预明显缓解了As处理导致的肝细胞增殖率下降(69.89%),相应的增殖率分别为84.92%、89.29%、89.58%和86.97%(图7C)。基于上述结果,本研究确定在后续的细胞模型研究中,As的处理浓度为10µmolL −1 ,LA的处理浓度为25µmolL −1 ,处理时间为24h。研究发现,LA的关键靶蛋白SIRT1被As下调,而LA能有效上调SIRT1的表达,这与体内研究结果一致(图7D)。而LA的干预则提高了肝细胞中蛋白的表达水平(图7F,G),这表明LA在细胞水平上对改善脂质代谢紊乱具有与体内观察到的相似的作用。
ACOX1蛋白检测结果表明,LA干预增加了ACOX1蛋白的表达,而As处理降低了ACOX1蛋白的表达,而TRCDA处理进一步降低了ACOX1蛋白在肝细胞中的表达(图7H,I)。这些研究结果表明,TRCDA抑制了过氧物酶体β-氧化,而β-氧化与As诱导的肝毒性调控和LA对肝脏的保护作用有关。
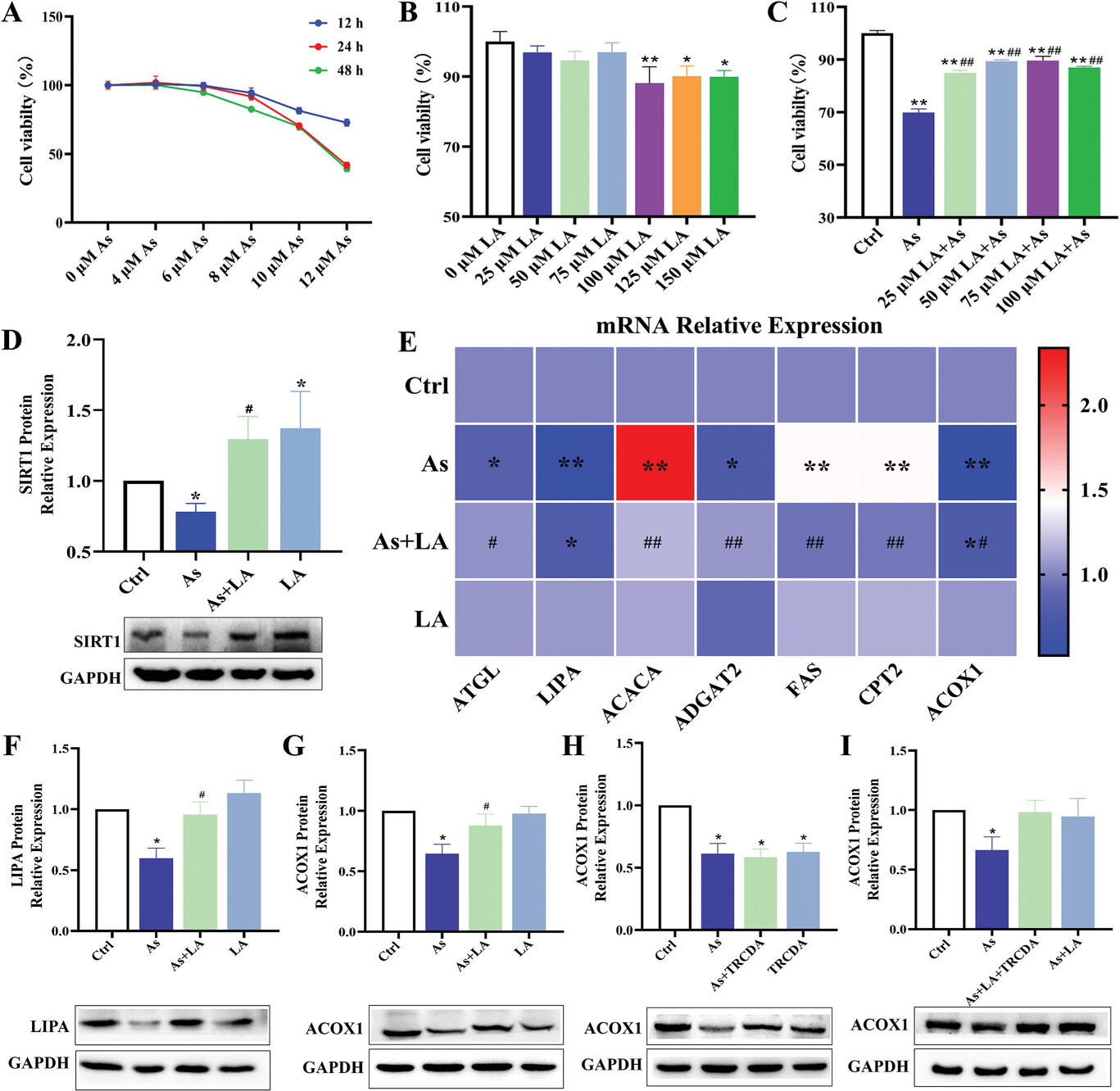
图7
8、TRCDA促进了砷诱发的脂质代谢紊乱和脂肪吞噬,同时降低了LA改善这两种情况的效果
采用肝细胞功能和脂质含量指标检测、荧光染色和流式细胞术检测过氧化物酶体β氧化抑制对LA改善As诱导的肝细胞损伤和脂质代谢紊乱的影响。如图8所示,As处理显著增加肝细胞的肝功能指标(AST和ALT,图8A)、脂代谢指标(TG和T-CHO,图8B)、细胞死亡率(图8C-E)、ROS含量(图8D,E)、细胞外酸化率(ECAR,图8F)、线粒体膜去极化率(图8G),但增加了肝细胞的耗氧率(OCR,图8F)。
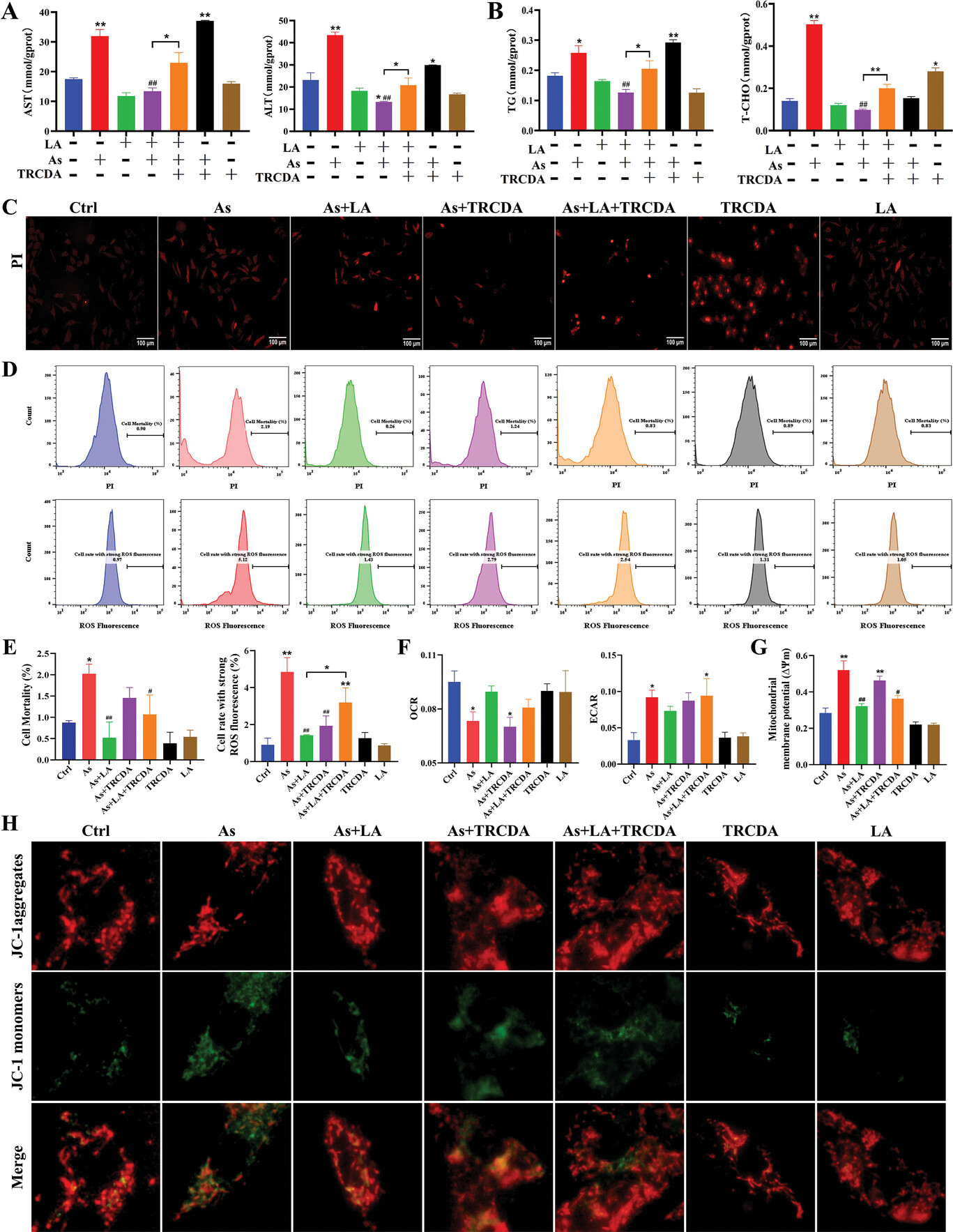
图8
本研究还从LA改善As诱导的肝损伤的角度研究了过氧化物酶体β氧化对噬脂的调控作用。结果表明,As处理明显增加了肝细胞中噬脂荧光点的强度和数量,升高了肝细胞脂滴中LC3、ULK和P62的蛋白表达水平,降低了肝细胞脂滴中mTOR的蛋白表达水平,但LA的干预缓解了As诱导的上述变化(图9A-E)。此外,TRCDA处理进一步促进了As诱导的噬脂相关指标的变化,同时抑制了LA对As诱导的噬脂的改善作用(图9A-E)。这些结果表明,过氧物酶体β氧化调节噬脂作用,并在LA改善As诱导的肝损伤中发挥了重要作用。
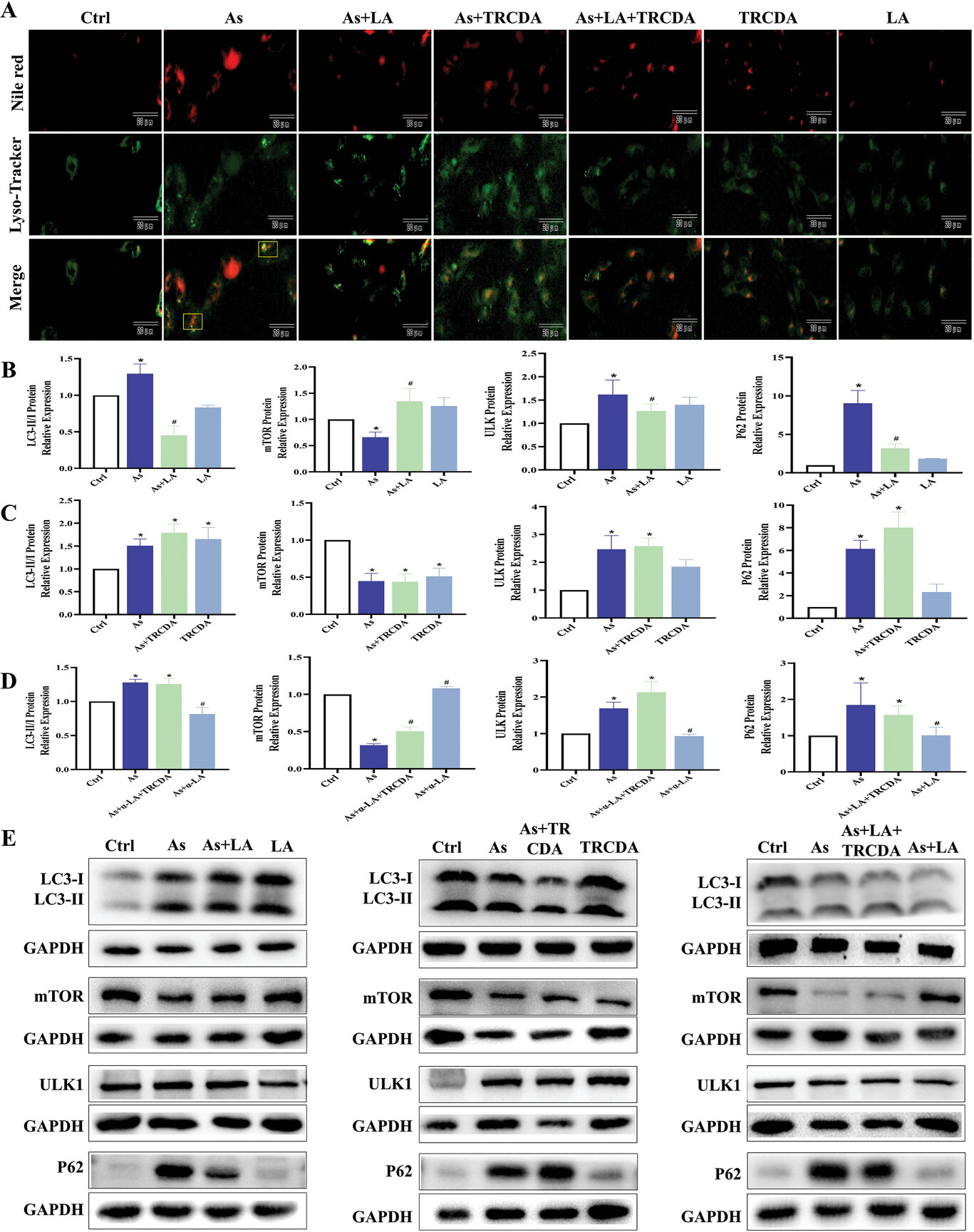
图9
总结:本文旨在探讨α-LA对As诱导的鸡肝脂质紊乱的改善作用及其潜在机制。这篇文章将网络药理学和网络毒理学的思路很值得学习,很有创新性!如果复现有困难,可以联系我们定制方案,傲星生物深耕生信分析十余载,有丰富的实验方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




