IF:6.0/Q1,单细胞分析+机器学习+单基因分析,揭示SLC7A1在骨肉瘤中的作用!
题目:SLC家族转运体的单细胞图谱分析:揭示SLC7A1在骨肉瘤中的作用
英文名:Single-cell profiling of SLC family transporters: uncovering the role of SLC7A1 in osteosarcoma
杂志:Journal of Translational Medicine
影响因子:6.0/Q1
发表时间:2025年1月22日
研究背景:骨肉瘤是儿童和青少年最常见的恶性骨肿瘤,致残率和死亡率都很高。在过去的三十年中,治疗效果一直不理想,这凸显了对创新治疗靶点的迫切需要。溶质运载体(SLC)家族转运体与多种肿瘤的恶性进展有关,但它们在骨肉瘤中的具体作用仍鲜为人知。
研究思路:本研究利用数据库单细胞测序数据和RNA-seq数据进行分析。研究人员进行了LASSO回归分析,以确定预后基因并构建SLC相关预后特征。生存分析和ROC分析评估了预后特征的有效性,评估免疫浸润状态。为了研究SLC7A1、恶性表型和免疫微环境之间的关系,还进行了伪时间和CellChat分析。CCK8测定、EdU染色、集落形成测定、Transwell测定和共培养系统用于评估SLC7A1对细胞增殖、转移和巨噬细胞极化的影响。最后,虚拟对接确定了靶向SLC7A1的潜在药物。
研究结果:
1、骨肉瘤scRNA-seq数据集中SLCs的分布情况
为了研究骨肉瘤中溶质载体(SLC)家族基因的分布,利用单细胞RNA测序数据集进行了分析。降维和聚类显示了八个主要细胞系:B细胞、内皮细胞、成纤维细胞、髓样细胞、NK/T细胞、破骨细胞、骨肉瘤(OS)细胞和周细胞(图 1 A)。这些细胞类型在不同样本中的比例各不相同(图 1 B)。气泡图显示了每种细胞类型的比例表达水平和特定标记物的比例(图 1 C),而火山图则说明了各系间显著差异表达的基因(图 1 D)。利用CellChat分析,我们发现了不同细胞类型之间的多种相互作用(图 1 E、F)。
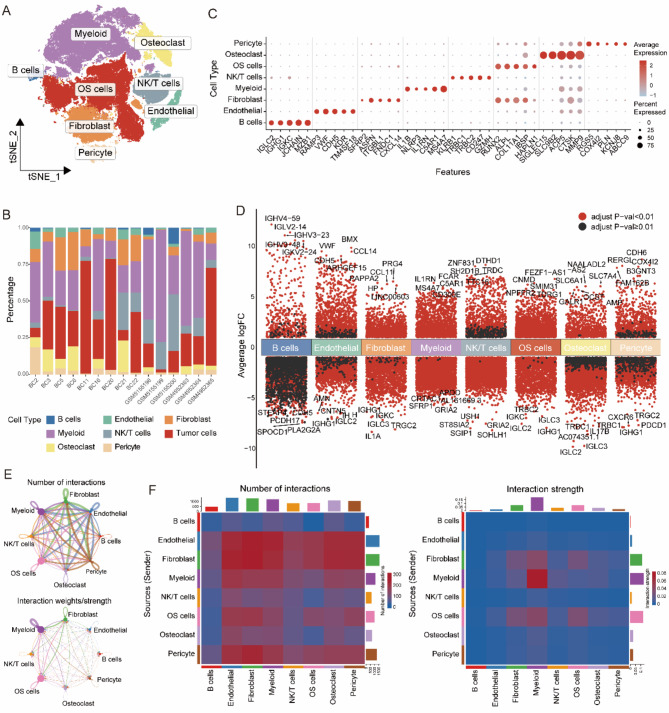
图1
单细胞测序数据揭示了不同细胞类型中溶质运载体(SLC)超家族基因不同的表达模式(图 2 A、B)。破骨细胞的SLC得分highest,其次是骨髓细胞和B细胞,然后是OS细胞,而其他细胞类型的得分较低(图 2 C)。进一步分析发现,破骨细胞的CM-SLC和NM-SLC得分相对较高,骨髓细胞的AAM-SLC得分较高,肿瘤细胞的NM-SLC得分仅次于破骨细胞(图 1 A,图 2 D-E)。与此相反,不同类型细胞的LM-SLC得分都很低(图 2 F)。
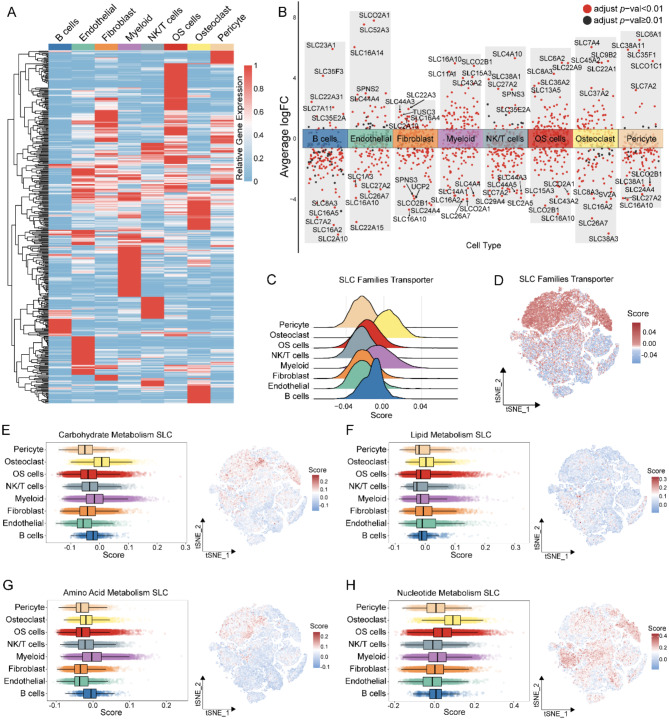

图2
2、基于SLC和生存分析构建骨肉瘤预后风险评分模型
采用LASSO惩罚性Cox回归分析来确定与预后相关的SLC家族基因(图 3 A、B)。该分析确定了九个预后基因(图 3 C)。生存期分析表明,与低风险组相比,高风险组的总生存期明显较短(图 3 D、E)。在测试集和外部验证队列 中也观察到了类似的结果(图 3 F-I)。随后,构建了一个包含临床参数和SLC风险模型,表明在预测总生存率方面具有良好的准确性(图 3 J- L)。
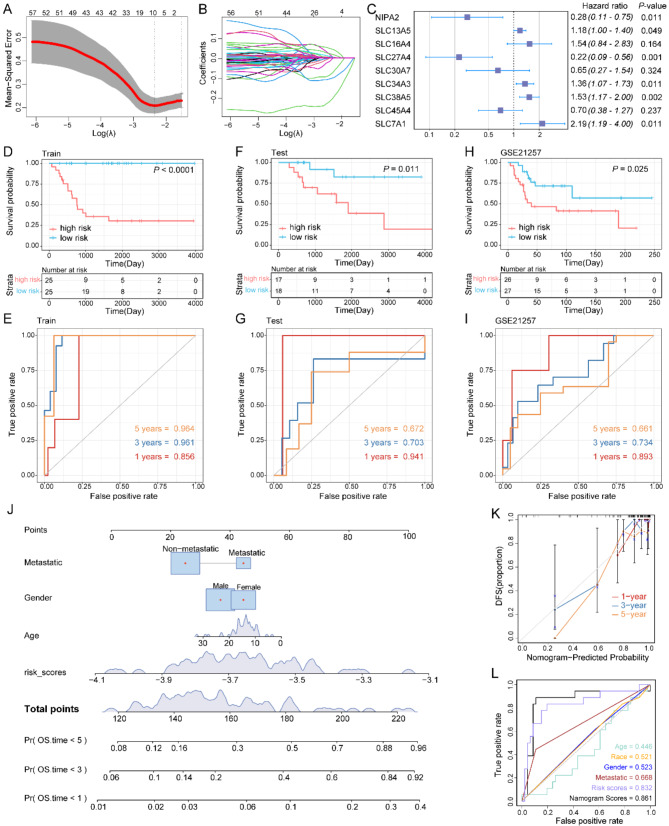
图3
3、骨肉瘤患者SLC相关预后特征的免疫图谱
GO富集分析结果显示,差异基因在与通过质膜粘附分子的嗜同性细胞粘附、免疫球蛋白介导的免疫反应和激活免疫反应相关的通路中明显富集(图 4 A、B)。免疫细胞浸润分析显示,发现了高风险组和低风险组之间幼稚CD4T细胞和记忆激活CD4+T细胞浸润的差异,巨噬细胞、肥大细胞和单核细胞的浸润水平在两组之间存在显著差异(图 4C-E)。
免疫检查点基因的差异表达分析表明,CD274、CD44、CTLA4、ICOS、KIR3DL1、LAG3、NPR1、TIGIT和TNFSF4在低危组的表达水平显著高于高危组(图 4 G)。SLC7A1与活化的NK细胞和单核细胞呈显著负相关,而与活化的树突状细胞(DC)呈正相关(图 4 H)。这些研究结果表明,SLC家族基因的表达与骨肉瘤的免疫调节有关,突显了它们在免疫微环境中的潜在调节作用。

图4
4、骨肉瘤细胞中SLC7A1的单细胞分析
气泡图显示,SLC7A1的表达水平升高,在OS细胞中表达细胞的比例较高(图 5 A)。进一步的聚类分析将OS细胞分为五个不同的组,每个组都有独特的基因表达谱(图 5 B、C)。值得注意的是,SLC7A1阳性细胞主要出现在OS4组(图 5 D-F)。使用Monocle算法推断OS细胞的分化轨迹(图 5 G),确定OS4组细胞占据了这一轨迹的末端(图 5 H),SLC7A1的表达在这一轨迹上有显著差异(图 5 I、J)。用scMetabolism算法评估了各肿瘤组的代谢途径活性,发现与SLC7A1的高表达一致,OS4细胞在精氨酸生物合成、精氨酸和脯氨酸代谢以及糖酵解/葡萄糖生成等途径中表现出更强的活性(图 5 K)。对14个肿瘤特征基因组的评分显示,SLC7A1阳性细胞具有更强的增殖和转移能力,以及更强的干性(图 5 L)。
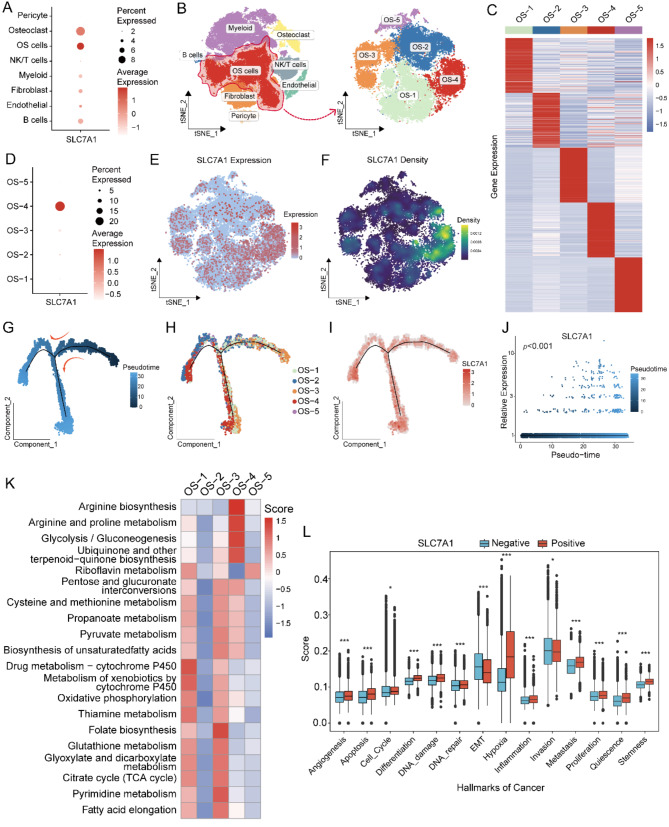

图5
5、SLC7A1在体外促进骨肉瘤的增殖和转移,并与预后不良有关
免疫印迹显示,SLC7A1在肿瘤组织中上调(图 6 A)。随后,选择了143B和SJSA-1骨肉瘤细胞系,并在体外进行了SLC7A1基因敲除(图 6 B)。这种敲除导致增殖能力降低(图 6 C),这也表现在EdU阳性细胞比例降低和集落形成减少(图 6 D、E)。此外,SLC7A1敲除还能显著抑制两种细胞系的细胞侵袭、迁移和成球能力(图 6 F-H)。为了验证SLC7A1对预后的影响,使用免疫组化技术(IHC)分析了70例骨肉瘤标本中SLC7A1的表达情况(图 6 I)。Kaplan-Meier分析显示,SLC7A1高表达与较差的总生存期和无肺转移生存期相关(图 6 J)。单变量和多变量回归分析均确定SLC7A1水平是一个独立的预后因素(图 6 K)。这些研究结果表明,SLC7A1可能是骨肉瘤有价值的治疗靶点和预后标志物。
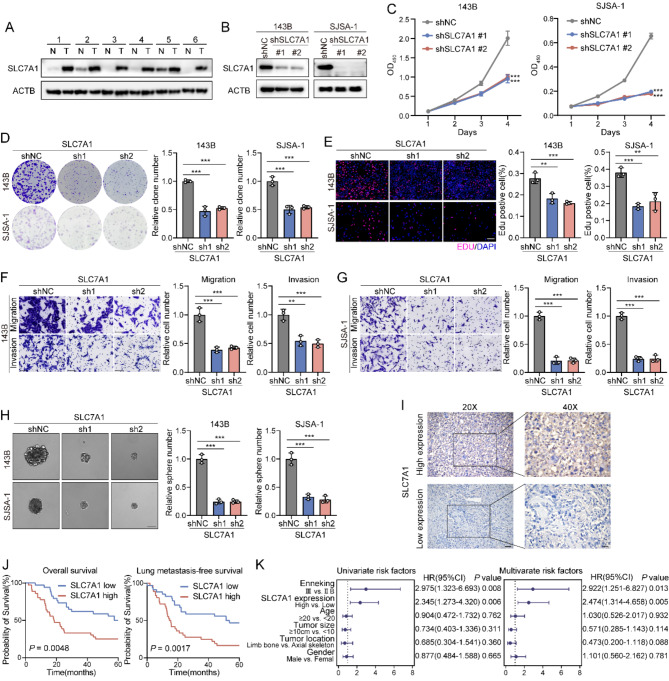
图6
6、SLC7A1表达与肿瘤免疫微环境的关系
根据肿瘤细胞中SLC7A1的水平将15个单细胞样本分为SLC7A1高表达组和低表达组。分析结果显示了不同的细胞类型组成,高表达组中髓系细胞明显减少(图 7 A)。对分离出的髓样细胞进一步降维和聚类,发现了四种不同的类型图 7 B-D)。对细胞组成的再分析证实,高表达组的TAMs显著减少(图 7 E)。
对TAMs进行了代谢分析,发现SLC7A1高表达组的精氨酸生物合成增强,而精氨酸和脯氨酸代谢减弱,表明这种微环境中可能存在精氨酸缺乏(图 7 F)。细胞通讯分析发现肿瘤细胞与巨噬细胞之间的相互作用频率更高、强度更大(图 7 G)。与其他免疫细胞相比,TAM从骨肉瘤细胞接收到更多的信号(图 7 H)。进一步比较高SLC7A1表达组和低SLC7A1表达组之间的细胞间通讯表明,高SLC7A1表达组的骨肉瘤细胞向TAMs发出了更多的信号,尽管信号强度略有降低(图 7 I)。并进行了差异信号通路分析(图 7 J-K)。
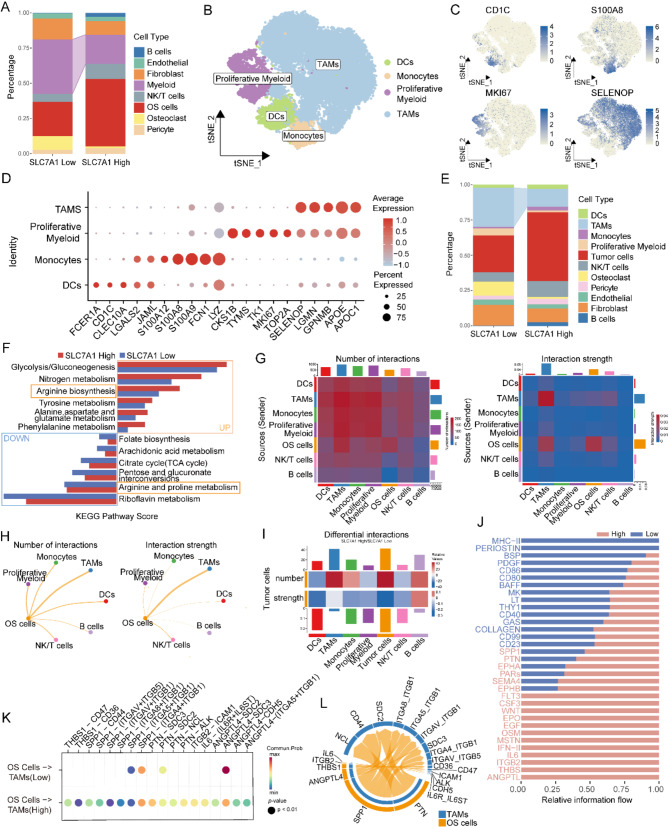
图7
7、SLC7A1影响M2巨噬细胞的极化
采用共培养模型研究了骨肉瘤细胞中SLC7A1的表达对肿瘤相关巨噬细胞(TAMs)分化的影响(图 8 A)。流式细胞术显示,与对照组细胞相比,SLC7A1-敲除组的CD206表达明显减少,CD86表达略有增加(图 8 B、C)。此外,qPCR分析表明,M2巨噬细胞标记物,包括CD206、ARG1、IL-10、TGFB1和CD163有明显上调(图 8 D)。这些发现表明,骨肉瘤细胞中SLC7A1的表达促进了微环境中M2样巨噬细胞的极化。
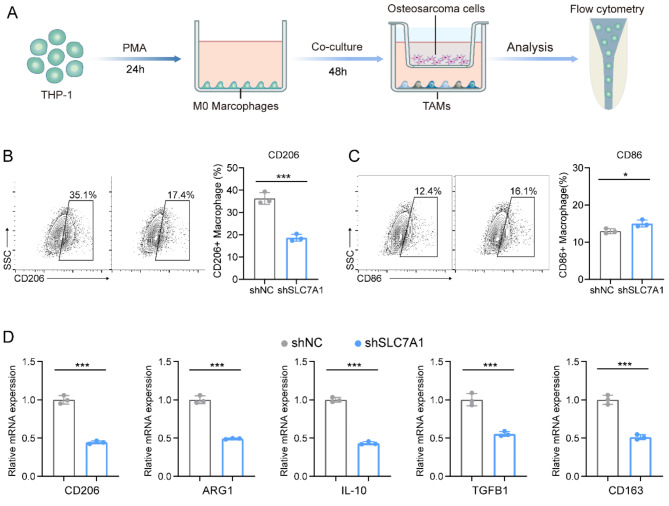
图8
8、基于结构的虚拟筛选确定头花千金藤碱是SLC7A1的潜在抑制剂
通过基于结构的虚拟筛选,以确定可能抑制SLC7A1功能的已批准药物(图 9 A)。使用AlphaFold2预测了SLC7A1蛋白结构(图 9 B),预测的配准误差图显示大多数区段的置信度很高(图 9 C)。该模型的质量与核磁共振和X射线晶体学得出的模型质量相当(图 9 D)。这些药物的分子对接可视化图以白色显示SLC7A1蛋白模型,蓝色棒状显示药物分子,黄色虚线显示氢键,并标注了参与相互作用的氨基酸残基(图 9 E-N)。

图9
在10µM的浓度下进一步筛选这10种药物(图 10 A)。IC50分析表明,Cepharanthine(CPE)(5.13µM)对骨肉瘤细胞的半抑制浓度minimum(图 10 B)。细胞热转移试验(CETSA)表明,CPE能抑制热诱导的SLC7A1蛋白降解(图 10 C),随着浓度的增加,CPE增强了对精氨酸摄取和细胞增殖的抑制作用(图 10 D、E)。为了评估CPE预处理对骨肉瘤细胞诱导的巨噬细胞极化的影响,收集了用或不用CPE预处理24小时的骨肉瘤细胞的条件培养基,并将其用于培养THP1衍生的巨噬细胞(图 10 F)。培养48小时后,流式细胞术分析表明,CPE预处理显著下调了CD206的表达,上调了CD86的表达,这些效应随着CPE浓度的增加而增强(图 10 G、H)。这些研究结果表明,千金藤素通过与 SLC7A1 结合并抑制其活性发挥抗肿瘤作用。

图10
总结:本文的分析,可以看作是“单基因”分析的升阶版!从SLC转运蛋白基因家族切入,重点是单细胞分析与机器学习构建预后模型,最后进行了单基因分析,常规实验验证。文章方法易复现,傲星生物不仅具有丰富的分析经验、还提供完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




