IF:12.4,网络药理学+转录组+机制实验,解析隐丹参酮防止腹主动脉瘤形成!
题目:通过隐丹参酮靶向平滑肌细胞Keap1-Nrf2-GSDMD-焦亡轴可防止腹主动脉瘤形成
英文名:Targeting the smooth muscle cell Keap1-Nrf2-GSDMD-pyroptosis axis by cryptotanshinone prevents abdominal aortic aneurysm formation
杂志:THERANOSTICS
影响因子:12.4
发表时间:2024年10月07
研究背景:腹主动脉瘤(AAA)是一种炎症性、致命的主动脉疾病,目前缺乏任何有效的药物。隐丹参酮(CTS)是一种突出且廉价的生物活性物质,来源于丹参Bunge,这是一种众所周知的草药,通过其强大的抗炎特性治疗心血管疾病。然而,CTS对AAA形成的治疗效果仍然未知。
研究思路:为探讨CTS对AAA的治疗效果,采用多种实验方法,主要包括AAA小鼠模型建立、实时聚合酶链反应(PCR)、RNA测序、蛋白质印迹、免疫共沉淀、扫描/透射电子显微镜(SEM/TEM)、酶联免疫吸附测定(ELISA)、seahorse分析、免疫组化和共聚焦成像。在这项研究中,作者证明CTS抑制了输注AngII的载脂蛋白E敲除(ApoE-/-)小鼠中AAA的形成。网络药理学和转录组测序分析的结合表明,血管平滑肌细胞(VSMC)中Keap1-Nrf2通路的激活和程序性细胞死亡的调节与CTS的抗AAA作用密切相关。利用分子对接,结合细胞热位移测定(CETSA)和等温滴定量热法(ITC),在CTS和Keap1之间的Arg415位点建立了一个特定的结合位点。
研究结果:
1、CTS抑制AngII诱导的ApoE-/- 小鼠AAA形成
使用了AngII诱导的小鼠AAA模型,十二周大的雄性ApoE-/-小鼠在AngII输注当天每天给予低剂量或高剂量的CTS(CTS-L或CTS-H)或载体(图1A)。在实验终点,AngII输注组的收缩压高于生理盐水组,无论是否使用CTS治疗都没有显着差异(图1B)。高剂量的CTS显著提高了小鼠AAA模型中的存活率(图1C-D)。相比之下,CTS-L组只有46.7%(7/15)的小鼠和CTS-H组只有26.7%(4/15)的小鼠出现了AAA(图1D)。还观察到CTS治疗后maximum腹主动脉直径显著降低(图1E-F)。

图1
H&E和EVG染色表明CTS大大减轻了弹性蛋白的损伤和恶化(图1G-I)。此外,CTS治疗导致剂量依赖性相当大且阳性区域较小(图1J)。AngII灌注小鼠主动脉中层的VSMCs与生理盐水对照小鼠相比,α-SMA和SM22α水平显著下降,而CTS有效地挽救了α-SMA和SM22α的下降(图1J-L)。CTS处理小鼠主动脉中的MMP活性显着降低(图1M-N)。这些结果表明CTS阻碍AAA的形成,并维持血管平滑肌细胞稳态AngII诱导小鼠AAA模型。
2、CTS在体外AAA模型中协调VSMC表型、炎症、氧化应激和线粒体功能
CTS剂量依赖性地抑制了TNF-α诱导的血管细胞粘附分子-1(VCAM-1)和基质金属蛋白酶(MMP2、3和9)的蛋白表达,这在RAVSMCs(图2A)和MAVSMCs中起着关键作用。如图2B所示,CTS以剂量相关的方式增加弹性蛋白表达,同时防止TNF-α-诱导的RAVSMCs和MAVSMCs中SMC收缩表型标志物SM22α和α-SMA表达的减少。通过DHE染色和流式细胞术评估的ROS水平在TNF-α或AngII处理中显着升高,而CTS有效地抑制了这种升高(图2C-H)。因此,抗氧化剂超氧化物歧化酶(SOD)水平和ATP水平降低,而在TNF-α暴露的VSMCs和AngII处理的小鼠血清中,氧化应激指标丙二醛(MDA)水平升高,CTS阻止了这种影响(图2I-L)。CTS处理减少了细胞培养上清液中的LDH释放(图2M)。CTS处理后,细胞表现出接近正常的形态,没有明显的超微结构损伤(图2N)。此外,TNF-α处理诱导VSMCs的耗氧率(OCR)和细胞外酸化率(ECAR)显著增加,而CTS处理有效地逆转了TNF-α诱导的线粒体功能障碍和糖酵解增加(图2O-P)。将VSMCs暴露于TNF-α会导致细胞质dsDNA和mtDNA数量的增加,而CTS处理逆转了这种影响(图2Q-R)。
总体而言,这些发现表明CTS抑制VSMC炎症、ROS产生和线粒体损伤,从而在TNFα诱导的AAA 体外模型中维持VSMC稳态。

图2
3、网络药理学结合RNA-seq分析表明,CTS激活Keap1-Nrf2-HO-1通路并抑制细胞死亡通路
为了绘制AAA中CTS交互目标的全局地图,使用了网络药理学(图3Aa-b)。在这个集中的网络中,以黄色标记的十个目标在AAA中至关重要,并且已被证明与AAA的进展密切相关,特别是Keap1-Nrf2-HO-1信号轴(图3Ac-d)。
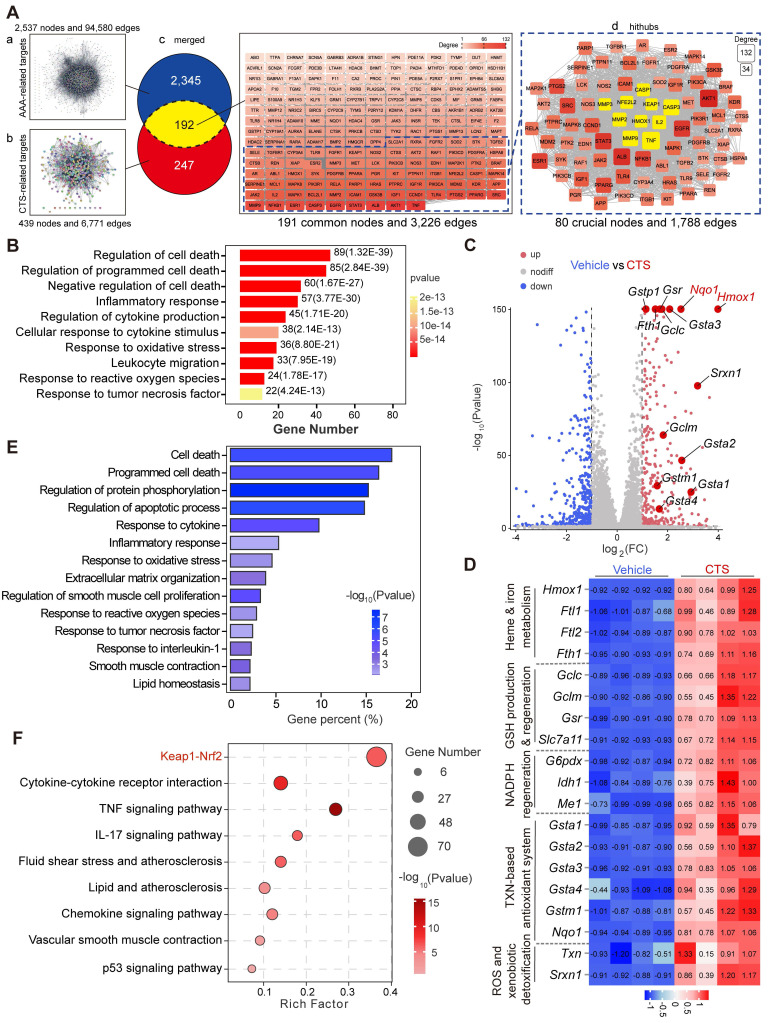
图3
CTS主要富集的途径集中在炎症反应和细胞死亡的类别上(图3B)。火山图显示,当暴露于CTS时,由转录因子Nrf2调节的靶基因增加,与其他基因相比,Hmox-1(HO-1的基因名称)表现出最显着的上调(图3C)。热图显示与载体组相比,CTS实验组中Nrf2靶基因的高转录(图3D)。此外,差异表达基因的KEGG分析表明,CTS对炎症和细胞死亡途径的调节有显著影响,与网络药理学的发现一致(图3E)。在GO富集分析中,很明显CTS对“Keap1-Nrf2途径”产生了影响,与网络药理学的结果一致(图3F)。
4、CTS激活Keap1-Nrf2-HO-1通路并抑制VSMC中的焦亡通路以预防AAA
根据网络药理学和RNA-seq的发现,CTS治疗在体内诱导了AngII灌注小鼠主动脉介质中VSMCs中Nrf2和HO-1的稳健蛋白表达(图4A-B)。进一步分析CTS对体外培养的VSMCs的影响,发现Keap1蛋白表达减少,Nrf2及其靶蛋白HO-1和NQO1显著增加(图4C)。Nrf2蛋白水平在细胞核和细胞质中均有所增加,其中增加在细胞核中更为明显(图4D)。免疫荧光染色进一步证实了这一点(图4E),表明Nrf2通路显著激活。

图4
RNA-seq数据显示,在TNF-α刺激的VSMCs中,Gsdmd的转录水平升高,而CTS治疗缓解了这种升高(图5a)。通过蛋白质印迹检测到焦亡途径中关键靶点的蛋白质水平,包括NLRP3、Cle-Caspase1、N-GSDMD、IL-1β和IL-18,并显示在AngII注入的小鼠主动脉组织或TNF-α处理的RAVSMCs中显着增加,同时被CTS抑制(图5B-E)。此外,IHC证实了小鼠主动脉横截面中NLRP3、Caspase1和GSDMD的表达(图5F-G),ELISA测定证实了小鼠血清中IL-1β、IL-18和其他两种关键的AAA相关细胞因子(TNF-α和IL-6)的释放(图5H)。最后,用相差显微镜和扫描电镜观察焦亡的形态学变化。在相差显微镜下,细胞呈现气球状形态。此外,SEM观察到VSMCs在TNF-α刺激下细胞大小肿胀和细胞膜上形成孔隙的明显迹象,而CTS治疗改善了异常形态学(图5I-J)。
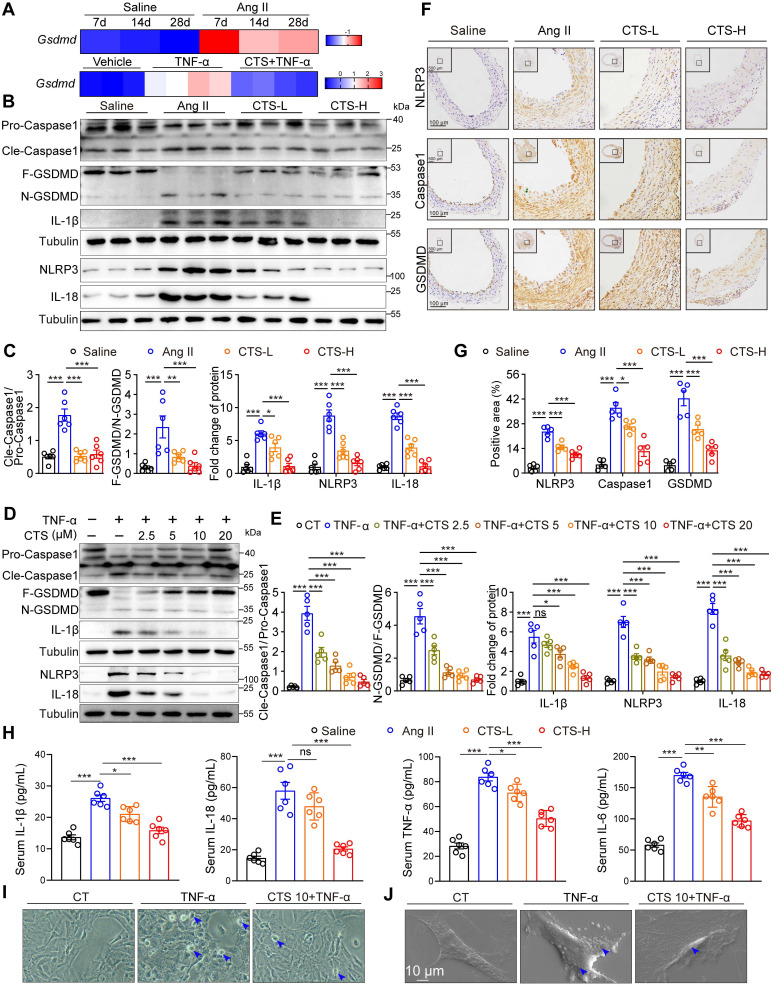
图5
5、CTS直接结合Keap1的Arg415残基激活Nrf2通路,改善氧化应激和炎症
使用CETSA、分子对接分析和ITC来确定CTS和Keap1之间是否存在直接接触。测定表明CTS对增加Keap1的热稳定性有实质性影响,Tm50为11.68°C(图6A)。此外,ITDRF-CETSA测定提供了进一步的证据,证明了IC50为2μM的CTS对Keap1蛋白的剂量依赖性结合和显着稳定(图6B)。分子对接分析显示CTS对Keap1的Arg415(R415)残基具有highest的亲和力(图6C)。Keap1R415K蛋白与CTS的热稳定性显著下降,与Keap1WT蛋白相比,Tm50值为7.41°C(图6D)。CTS对Keap1WT蛋白表现出更高的结合亲和力,而对突变的Keap1没有观察到明显的结合(图6E-F)。此外,Co-IP测定显示CTS治疗显著降低了Keap1蛋白水平与VSMCs中的Nrf2结合(图6G)。还观察到CTS处理后Nrf2的泛素化水平降低(图6H)。这些发现表明CTS直接与Keap1中的Arg415残基相互作用,从而阻碍Keap1和Nrf2之间的结合,阻止Nrf2泛素化和随后的降解,导致Nrf2逃逸和易位到细胞核以开始细胞保护基因的转录。

图6
DHE染色和流式细胞仪显示,在转染Keap1-WT的VSMCs中,CTS处理后ROS水平显着提高,但在Keap-R415K转染的细胞中没有(图7A-B)。此外,将Keap1R415K转染VSMCs显著抑制CTS诱导的Nrf2和HO-1蛋白表达上调(图7C-D)。此外,Western blot表明,CTS在转染Keap1WT的VSMCs中具有抗炎和抗焦亡作用,但在Keap1R415K中没有(图7C-D)。总之,CTS与Keap1中415位点氨基酸的结合对改善至关重要。
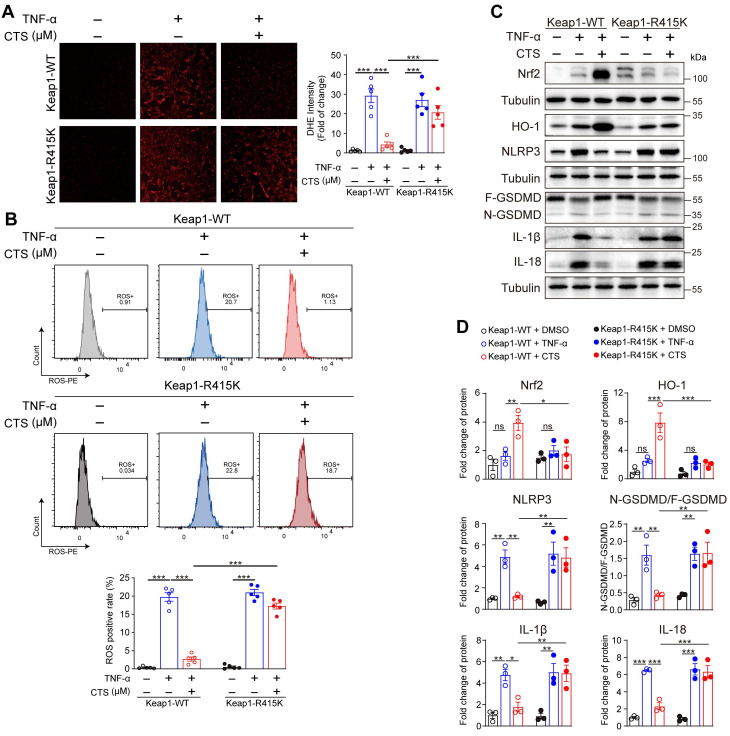
图7
6、在体外 AAA模型中,抑制Keap1-Nrf2通路可逆转CTS的保护作用
在ML385存在的情况下,CTS对MMPs(MMP2、3和9)以及VCAM-1蛋白水平的消除被完全消除(图8A)。观察到MMPs和AAA相关细胞因子(Il1b、Il6和Ccl2)的mRNA水平的类似结果(图8B)。此外,ML385部分损害了CTS恢复弹性蛋白和SMC收缩表型标志物(SM22α和α-SMA)蛋白水平的能力(图8C)。ML385处理也逆转了CTS介导的抗氧化能力,如使用流式细胞术(图8D-E)和DHE染色检测ROS水平所示(图8F-G)此外,CTS对NLRP3-Cle-Caspase1-N-GSDMD介导的焦亡的抑制作用通过ML385给药被废除(图8H)。总之,这些结果表明,CTS通过激活Nrf2在体外模型中在AAA中维持VSMC稳态并抑制VSMC焦亡。

图8
7、VSMC特异性 Nfe2l2 敲低消除了小鼠AAA模型中CTS的保护作用
荧光成像显示AAV特异性感染主动脉而不是其他器官(图 9 A)。小鼠主动脉的横截面显示GFP在中层中特异性表达(图 9 B)。此外,western blot分析表明,在AAV2病毒存在的情况下,大脑中Nrf2蛋白的表达是一致的,而主动脉明显降低(图 9 C)。将病毒注射到ApoE-/-小鼠中,以建立上述AngII诱导的小鼠AAA模型(图 9 D)。正如预期的那样,观察到CTS有效抑制了AngII注入的ApoE-/- 小鼠的AAA形成。有趣的是,当Nrf2在小鼠VSMC中沉默时,抑制作用减弱,如AAA发生率增加、存活率降低和腹主动脉maximum直径增加所示(图 9 E-H)。此外,组织学评估描述了Nrf2缺陷与CTS治疗效果受损之间的直接联系。这表现为显着的外膜增厚、弹性蛋白碎裂增加以及主动脉内层内胶原含量的显着降低(图 9 I-J)。免疫组织化学分析证实了这些发现,表明AAV介导的shNfe2l2 有效抑制了CTS诱导的VSMC中Nrf2的稳定和激活(图 9 K)。进一步的免疫荧光研究表明,CTS给药显着上调了VSMC中的Nrf2表达。使用AAV-shNfe2l2 阻碍了这种上调,同时导致α-SMA蛋白水平降低(图 9 L)。通过ELISA检测细胞因子,包括IL-1β、IL-6、IL-18和TNF-α,结果显示与AngII输注小鼠相比,CTS处理的小鼠明显减少。然而,CTS的治疗效果在很大程度上被Nrf2敲低所抵消(图 9 M)。
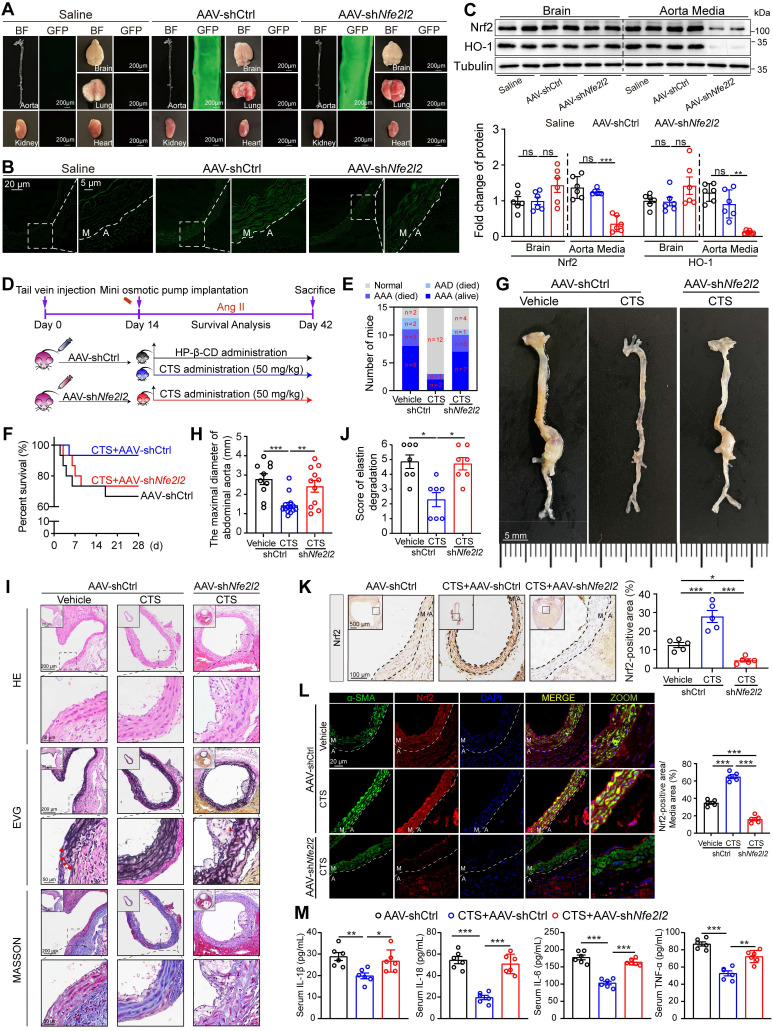
图9
此外,免疫组织化学染色显示,VSMCs中的Nrf2敲低通过增加炎症、促进VSMC表型转换和提高MMP水平来阻断CTS的治疗效果。尽管CTS治疗可以通过激活Nrf2介导的通路和弹性蛋白水平来改善AAA,但还是观察到了这一点(图 10 A),突出了Nrf2是AAA治疗的关键治疗靶点。Western blot分析进一步证明,Nrf2敲低大大削弱了Nrf2通路的激活以及NLRP3和焦亡通路的抑制(图 10 B)。综上所述,这些数据表明CTS通过激活Nrf2介导的抗炎作用和抑制NLRP3-caspase1引发的细胞焦亡,在治疗AAA方面很有希望。

图10
总结:本文通过网络药理学与转录组测序、分子对接并结合细胞热位移测定(CETSA)和等温滴定量热法(ITC)等湿实验,探究隐丹参酮 (CTS)对AAA的治疗效果的方式,是个很好的例子。傲星生物深耕生信分析十余载,有丰富的实验方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




