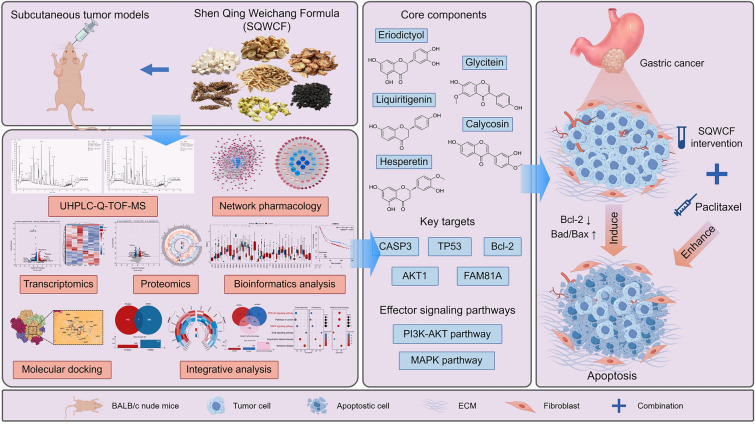
当网络药理学遇见多组学:神清胃肠方抗胃癌机制研究取得新突破!
题目:综合网络药理学、转录组学和蛋白质组学揭示了神清胃肠方对抗胃癌的物质基础和机制
英文名:Integrative network pharmacology, transcriptomics, and proteomics reveal the material basis and mechanism of the Shen Qing Weichang Formula against gastric cancer
杂志:Chinese Medicine
影响因子:5.1
发表时间:2025年3月29日
研究背景:胃癌(GC)是一种预后较差且缺乏有效治疗方法的常见恶性肿瘤。神清胃肠方(SQWCF)是一种用于治疗胃癌的专利中药方剂,但其疗效和作用机制尚不明确。本研究旨在探讨SQWCF治疗胃癌的疗效及其潜在机制。
研究思路:通过建立人胃癌皮下移植瘤小鼠模型评估SQWCF的疗效和安全性。采用质谱、网络药理学、组学分析和生物信息学方法综合探索SQWCF治疗胃癌的核心成分、关键靶点和潜在机制,并通过分子对接、免疫组化、定量实时PCR和Western blot进行验证。

研究结果:
1、SQWCF抑制了GC生长,体内安全性显著
为了评价SQWCF在GC中的抗癌作用和安全性,构建了BALB/c裸鼠皮下肿瘤模型,给予5种治疗方案(图1A)。在图1B-D中,5-FU和SQWCF组的肿瘤体积和重量显著下降。在3个剂量内,SQWCF抑制肿瘤生长;然而,低剂量时的抗GC作用不如其他剂量明显。中剂量和高剂量之间的疗效没有明显差异。因此,确定238mg/kg为SQWCF治疗GC的the best治疗剂量,并用于后续实验。
H&E和增殖标志物Kiel67(Ki-67)染色显示,SQWCF或5-FU处理显著抑制GC细胞的增殖(图1E-F)。此外,在图1G-J中,SQWCF处理后的体重或肝和肾的组织学形态和生化功能没有差异。5-FU处理的小鼠体重显著下降,肝和肾功能指标显著升高,表明在动物实验水平上使用SQWCF治疗GC是安全的。总之,SQWCF对GC的生长显示出明显的抑制作用,在体内没有明显的毒性迹象。
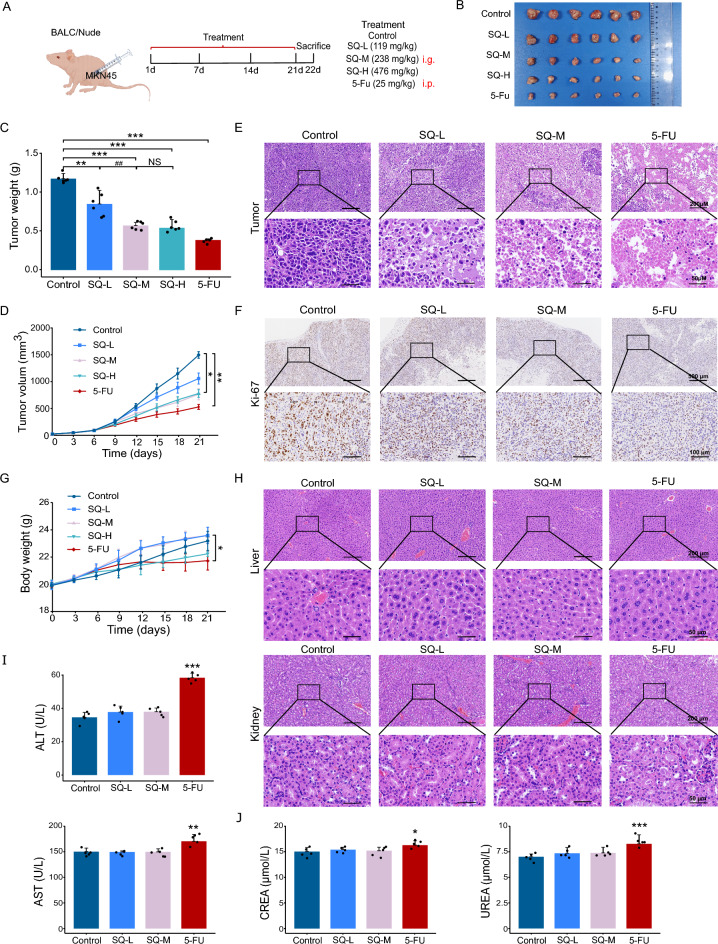

图1
2、SQWCF化学成分的鉴定
通过UHPLC-Q-TOF-MS分析得到232个成分。根据TCMSP数据库,筛选了34个化学成分进行网络药理学分析,包括23个黄酮类化合物、6个生物碱、3个萜类化合物和2个苯丙类化合物(图2C)。
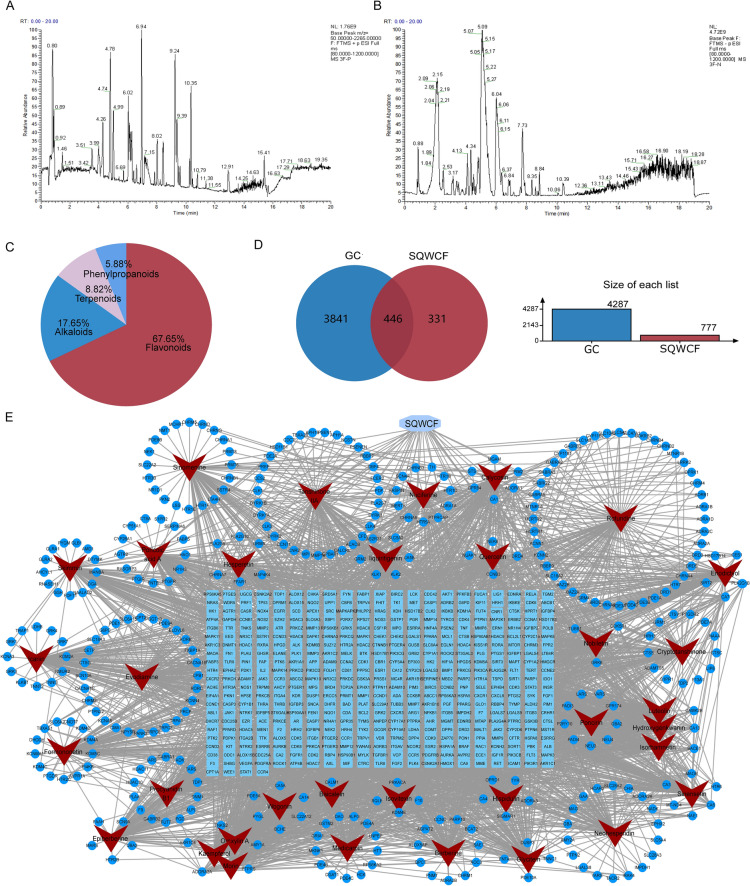
图2
3、网络药理学分析SQWCF抗GC的机制
从GeneCards、OMIM和DisGeNET、SwissTargetPrediction数据库中确定了777个组分相关靶点。在图2D中,两个数据集之间的交叉点确定了SQWCF在GC治疗中的446个共同靶点。为了更深入地了解化合物与靶点之间的复杂关系,建立了化合物-靶点网络(图2E)。使用SQWCF和GC的446个共同目标建立PPI网络(图3A)。随后,根据程度值识别SQWCF对抗GC的关键目标(AKT1、BCL2、TP53和CASP3)(图3B)。在图3C-D中,对446个常见靶点进行了GO和KEGG富集分析,以进一步阐明其生物学功能和潜在机制。KEGG通路富集表明,常见靶点基因主要参与癌症中的通路、PI3K-AKT信号通路、癌症中的蛋白聚糖和粘着斑。
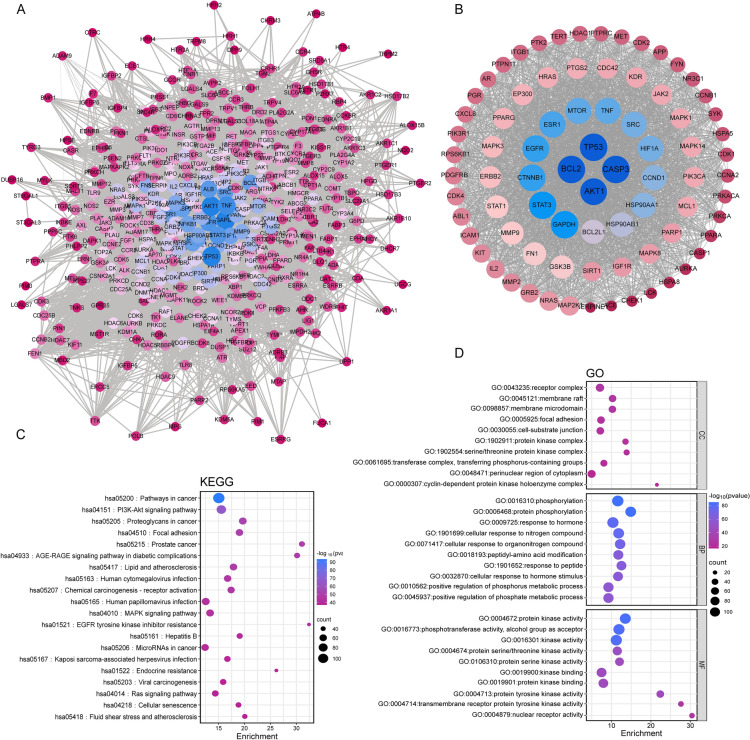
图3
4、SQWCF化合物与靶点相互作用的分子对接
采用分子对接分析来评估SQWCF的组分和靶标之间的结合能力。对接模型和得分如图4所示。详细地说,SQWCF的关键靶标和核心化合物的对接得分均低于−5kcal/mol,表明稳定的靶标-化合物结合能力。其中,AKT1和TP53对SQWCF的五个核心化合物显示了the best的对接活性(图4B-C)。
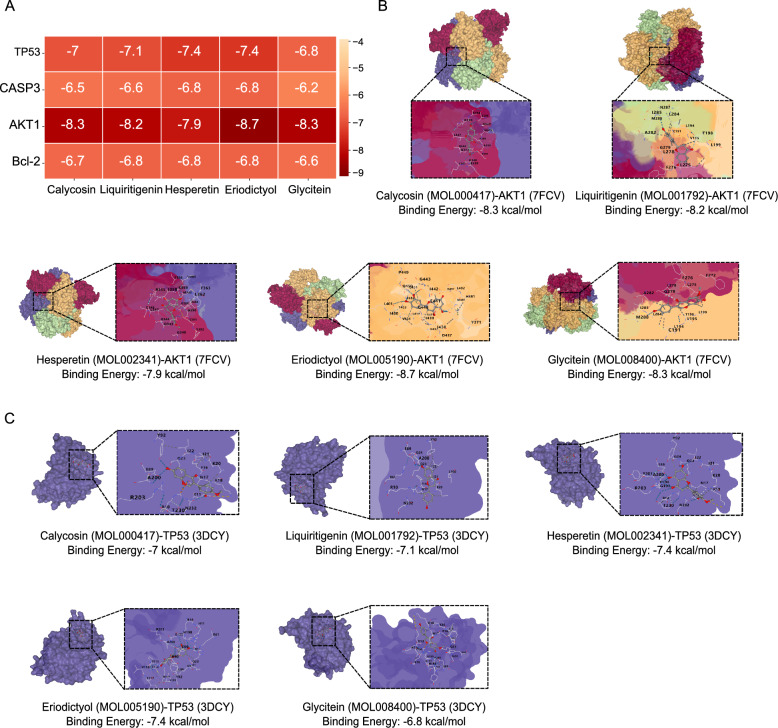

图4
5、通过转录组学分析鉴定与SQWCF对GC影响相关的基因和通路
为了进一步验证网络药理学的预测机制,对对照组和SQWCF组进行了转录组分析,发现了387个差异表达基因(DEGs),如图5a-B所示,包括133个上调基因和254个下调基因。随后,对DEGs的KEGG分析显示,癌症中的氧化磷酸化、PI3K-AKT信号通路、MAPK信号通路显著富集,癌症中的转录失调(图5C)。GO富集主要包括氧化还原酶活性、激酶结合、激素反应、单原子阳离子转运、线粒体膜和中心体(图5D)。此外,对DEGs的GSEA观察到SQWCF干扰后癌细胞中典型信号通路的激活或失活。
具体而言,SQWCF有效抑制了参与各种途径的基因的mRNA表达,包括细胞周期、中心碳代谢、泛素介导的蛋白水解和MAPK信号传导(图5E-F)。
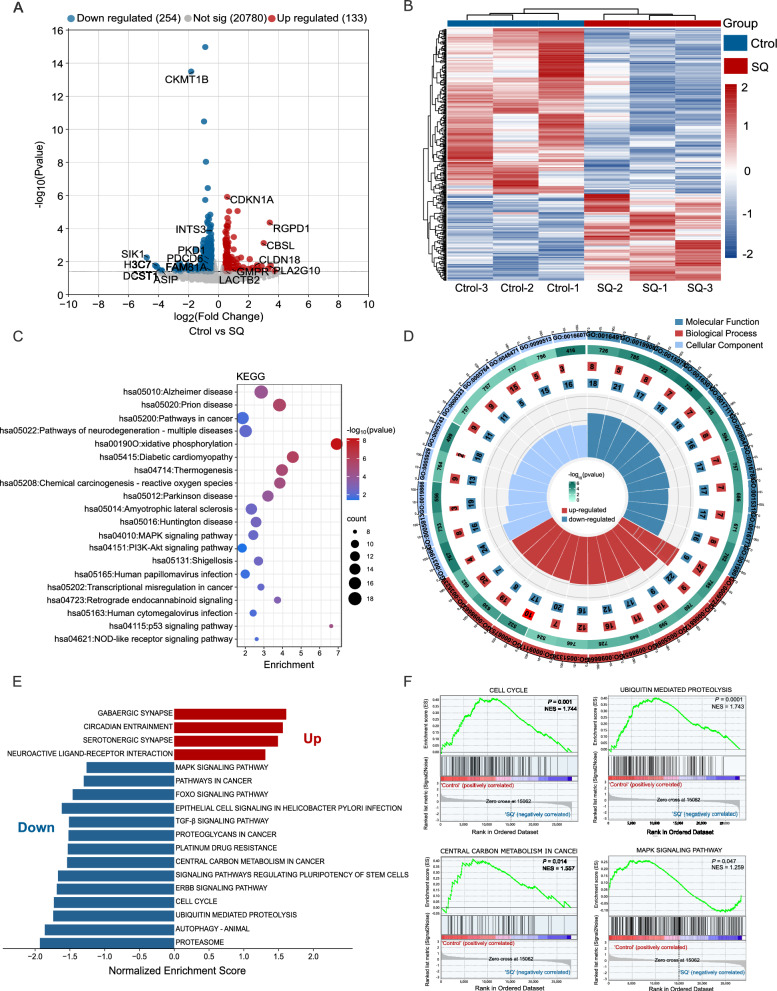
图5
6、通过蛋白质组学分析鉴定与SQWCF对GC影响相关的蛋白质和通路
为了揭示SQWCF干预GC进程的机制,我们对使用或不使用SQWCF的肿瘤组织进行了蛋白质组学分析,鉴定了对照组和SQWCF组之间187个差异表达蛋白(DEPs),包括101个上调蛋白和86个下调蛋白(图6A-B)。KEGG在癌症通路、Rap1信号通路、肌动蛋白细胞骨架调节、Ras信号通路和MAPK信号通路中富集了DEPs(图6C)。GO分析显示,这些DEPs主要富集于激酶结合、蛋白激酶结合、突触后、膜侧、细胞内蛋白质转运和蛋白质定位到细胞器(图6D)。
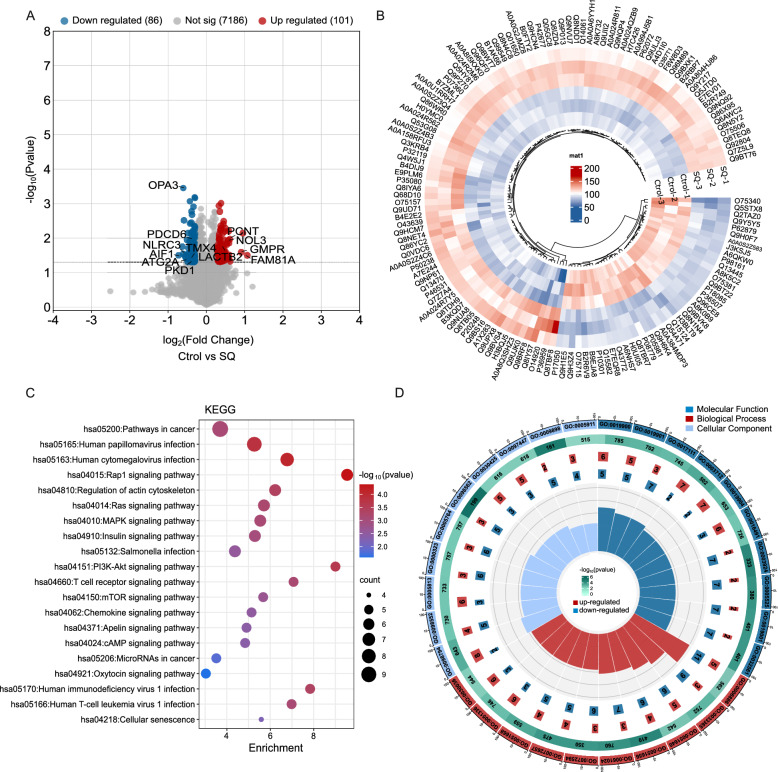
图6
7、SQWCF在mRNA和蛋白水平上对FAM81A表达的抑制作用
其次,采用基于交集的DEGs和DEPs分析来揭示SQWCF治疗GC的作用靶点。DEGs和DEPs共有7个共同靶点,如图7A所示。具体来说,FAM81A、PCNT和TMX4在mRNA和蛋白质水平上显示出一致的变化,TMX4上调,而FAM81A和PCNT下调(图7B-C)。随后,采用基因表达差异分析和生存分析来评估这三个基因在癌症诊断中的价值。
基于TCGA和GTEx的多种类型癌症中,FAM81A、PCNT和TMX4在肿瘤组织和正常组织中的表达存在显著差异。值得注意的是,这三个基因在GC组织中的表达异常高(图7D)。使用TCGA数据库数据的配对样本分析显示,与癌旁组织相比,FAM81A和PCNT在癌症中的表达同样显著增加(图7E)。我们随后的实验评估了FAM81A、PCNT和TMX4在GC患者总生存期(OS)中的预后价值。FAM81A的高表达与GC患者的不良预后显著相关(图7E)。FAM81A 的高表达与 GC 患者的不良预后显著相关(图7 F-H)。此外,SQWCF可以在mRNA和蛋白质水平上均匀抑制FAM81A的表达,表明FAM81A可以被认为是SQWCF发挥SQWCF抗GC活性的关键效应靶点。
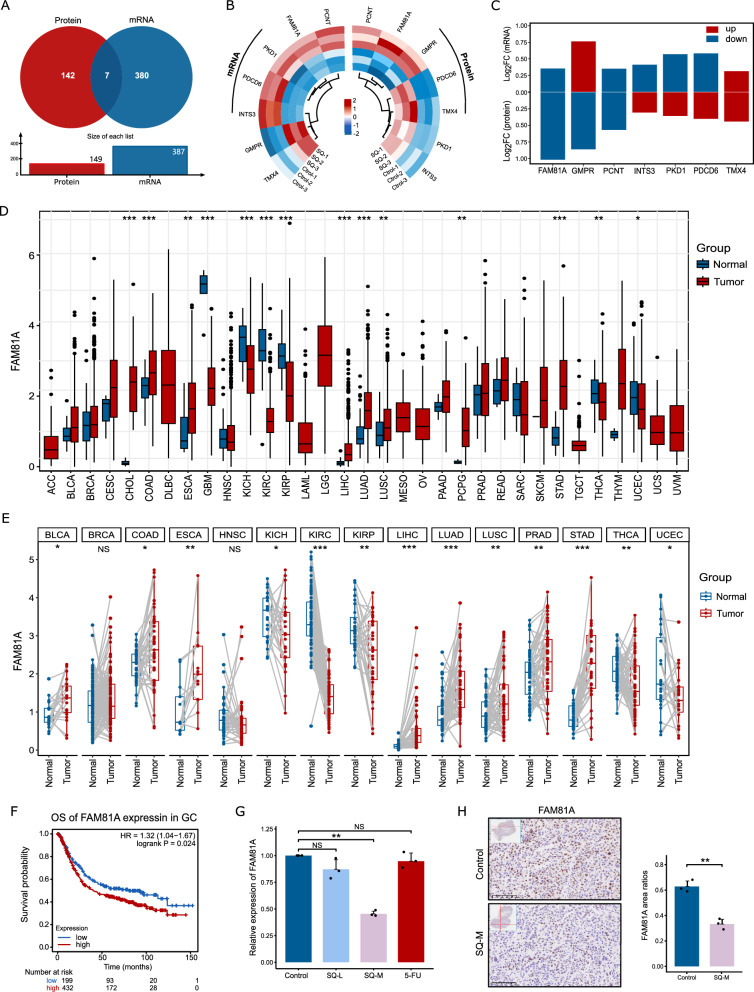
图7
8、SQWCF对抑制PI3K-AKT和MAPK信号通路及诱导下游细胞凋亡通路的影响
为了全面探讨SQWCF抗GC的潜在关键机制,将网络药理学富集途径与转录组学和蛋白质组学相结合(图8A-B)。在图8C-D中,SQWCF显著抑制了p-PI3K/PI3K、p-AKT/AKT、p-ERK/ERK、p-JNK/JNK和p-p38MAPK的表达,表明SQWCF有效抑制了PI3K-AKT和MAPK通路。检测凋亡标志物(Bcl-2、Bax、Bad、caspase3、cleaved-caspase3、PARP和cleaved-PARP),以调查凋亡通路的激活。
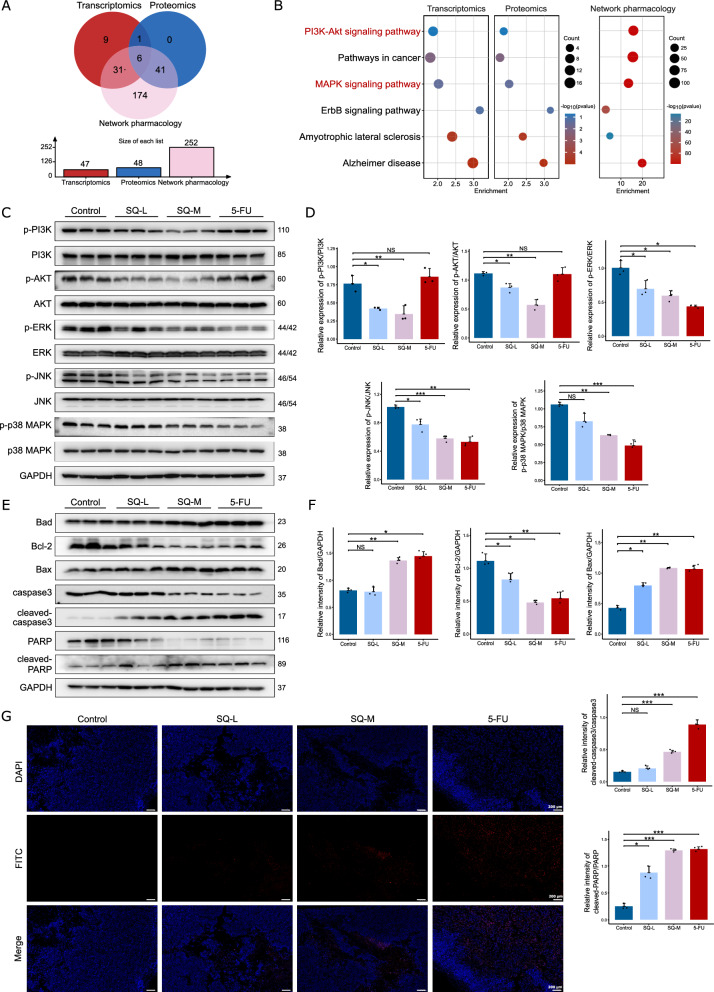
图8
9、SQWCF联合PTX对体内GC抑制的协同作用
如图9A-C所示,与对照组相比,治疗组观察到肿瘤体积和重量的显著减少。值得注意的是,联合治疗显示出优异的抗癌效果,优于SQWCF或PTX单独使用。在H&E染色中也获得了一致的结果(图9E)。此外,在联合实验组中,SQWCF减轻了PTX诱导的体重减轻(图9D)。此外,SQWCF显著抑制了PI3K和AKT的磷酸化(图9F-G),与上述发现一致。紫杉醇处理后PI3K-AKT信号通路的活性没有显著变化。然而,添加SQWCF后,该通路被明显抑制。此外,与对照组相比,治疗组凋亡相关蛋白Bax和Bad的表达水平增加,而caspase-3和Bcl-2的表达水平降低(图9H-I)。正如预期的那样,联合治疗导致比单独使用SQWCF或PTX更强的凋亡信号。
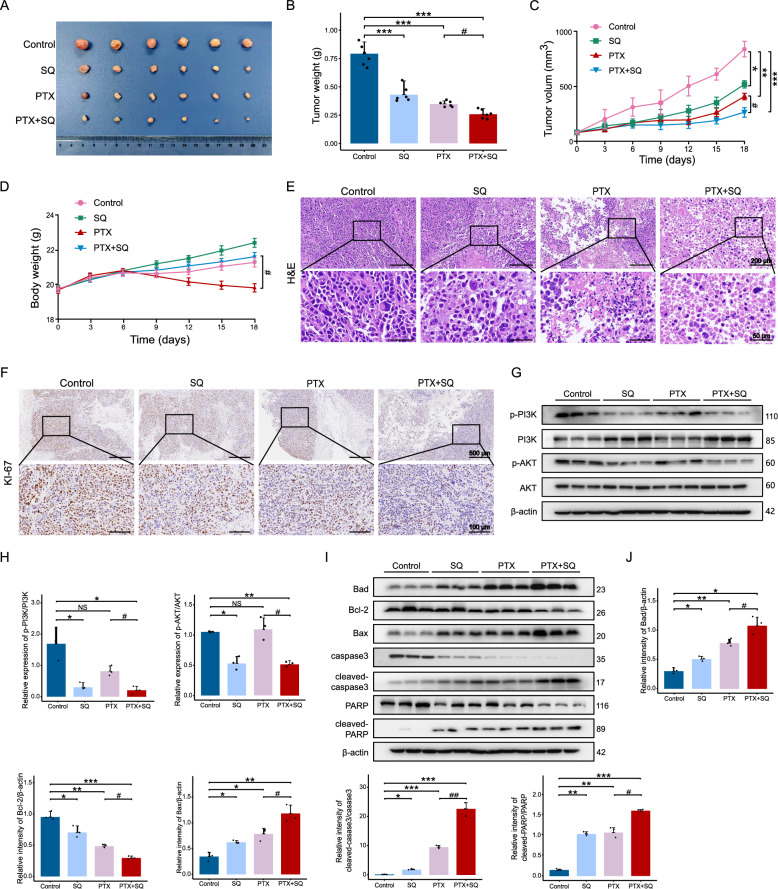

图9
总结:本研究通过多组学方法揭示了神清胃肠方对胃癌的疗效及其作用机制。结果表明,该方剂能有效抑制胃癌生长,且无明显毒性。其机制涉及抑制PI3K-AKT和MAPK信号通路,诱导凋亡,并下调FAM81A表达。此外,与紫杉醇联合使用可增强疗效。傲星生物深耕生信分析十余载,有丰富的实验方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




