101种机器学习组合+国自然热点:细胞衰老!这套组合拳屡试不爽!
题目:STAT3/TGFBI信号通过诱导细胞衰老上调糖酵解促进胶质母细胞瘤的替莫唑胺耐药
英文名:STAT3/TGFBI signaling promotes the temozolomide resistance of glioblastoma through upregulating glycolysis by inducing cellular senescence
杂志:Cancer Cell International
影响因子:5.3
发表时间:2025年4月3日
研究背景:胶质母细胞瘤(GBM)预后差且易对替莫唑胺(TMZ)产生耐药性。细胞衰老在肿瘤中的双重作用(促进免疫清除或肿瘤进展)机制尚不明确,且基于衰老相关基因的预后模型及耐药机制需进一步探索。
研究思路:研究者使用机器学习算法组合构建了一个基于CSRGs的预测模型(CSRGS)。通过分析胶质母细胞瘤样本,将患者分为高CSRGS组和低CSRGS组,发现高CSRGS组患者预后更差,免疫浸润更高,且对免疫检查点阻断疗法更敏感。研究还发现,与细胞衰老相关的糖酵解途径可能在GBM中起重要作用,TGFBI是关键调节因子,其表达受STAT3调控,并影响细胞衰老、糖酵解和替莫唑胺耐药性。
研究结果:
1、识别预后GBM相关CSRG
采用图1A所示程序进行生物信息学分析。首先,共鉴定809个CSRGs。然后,通过交叉CSRGs和GBM与正常脑组织之间的常见DEGs鉴定270个GBM相关CSRGs。最后,通过单变量Cox回归分析鉴定25个预后GBM相关CSRGs。这些基因的表达谱和预后价值如图1B-C所示。
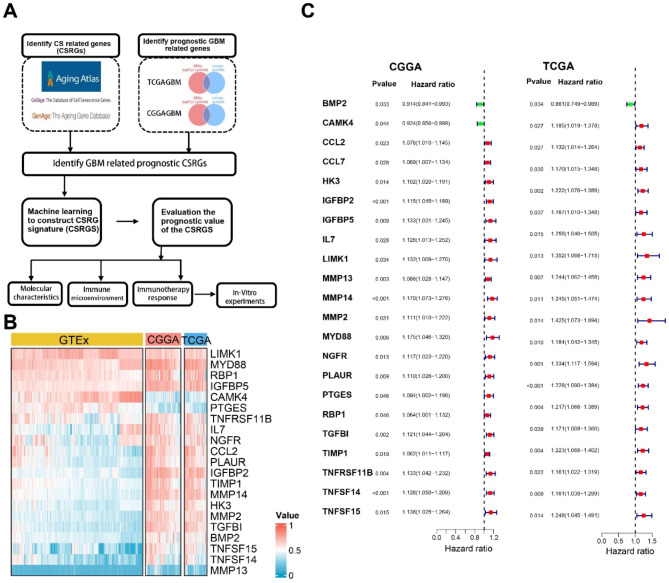
图1
2、CSRGS的开发
为了开发预测性CSRGS特征(CSRGS),基于CoxBoost和Ridge组合算法(图2A)建立了性能the best的最终CSRGS,CoxBoost算法识别了9个最有价值的CSRGS。在CGGA和TCGA数据集中,CSRGS评分高的胶质母细胞瘤(GBM)患者总生存期(OS)缩短(图2B)。与此结果一致,CGGA数据集中1年、3年和5年OS的时间依赖性受试者工作特征(ROC)曲线下面积(AUC)值分别为0.611、0.723和0.718,而TCGA数据集中的AUC值分别为0.687、0.634和0.667,从而证实了CSRGS的预后意义(图2C)。此外,计算了GBM患者临床特征的C指数,并对这些临床变量进行了多因素Cox回归分析。结果显示,CSRGS是一个独立的预后决定因素,与年龄、性别、化疗、放疗、异柠檬酸脱氢酶(IDH)状态以及O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)甲基化状态等因素相当。值得注意的是,在CGGA和TCGA数据集中,CSRGS的预测能力均优于这些临床特征(图2D和E)。
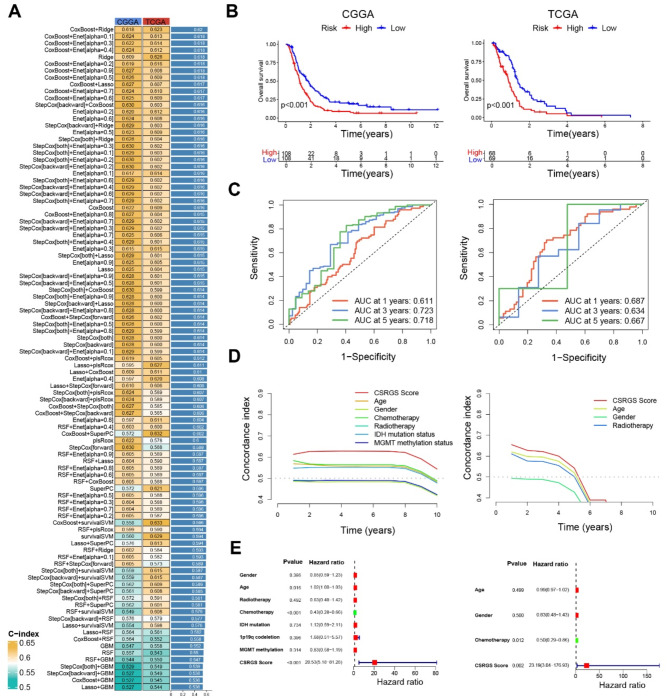
图2
3、CSRGS组的免疫特性和免疫治疗反应
如图3A所示,几乎所有类型的肿瘤浸润细胞在高CSRGS组中都更高。同样,基于CIBERSORT算法,调节性T细胞、巨噬细胞和中性粒细胞在高CSRGS组中更高,然而,活化的NK细胞和单核细胞在高CSRGS组中更低(图3B)。如图3C所示,经典的免疫检查点分子在高CSRGS组中表达显著升高。此外,肿瘤微环境(TME)基因集和免疫表型调节因子基因集的评在高CSRGS组中也显著更高(图3D)。最后,免疫治疗预测指标GEP评分(图3E)和CYT评分(图3F)在高CSRGS组中的水平也显著更高。
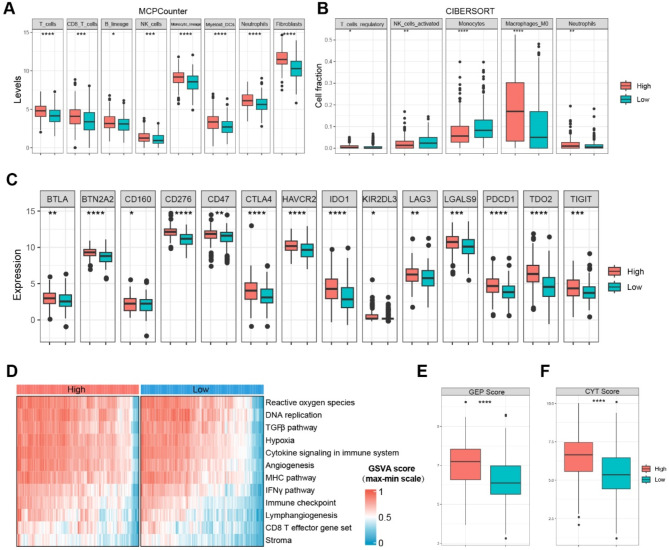
图3
4、CSRGS的分子特征
如图4A所示,正如预期的那样,衰老相关生物学过程或通路的GSVA评分在高CSRGS组均显著更高。为了进一步研究CSRGS组的分子特征,选择了由细胞成分、发育、DNA损伤、免疫、代谢、信号传导、通路和增殖八个过程类别组成的标志性基因集,并使用GSVA算法进行量化。如图4B所示,几乎所有基因集在高CSRGS组均显著更高。在七条代谢途径中,糖酵解在高CSRGS组相对于低组表现出maximum程度的升高。值得注意的是,糖酵解与衰老通路的相关性最强,表明高糖酵解是衰老的胶质母细胞瘤的一个标志。
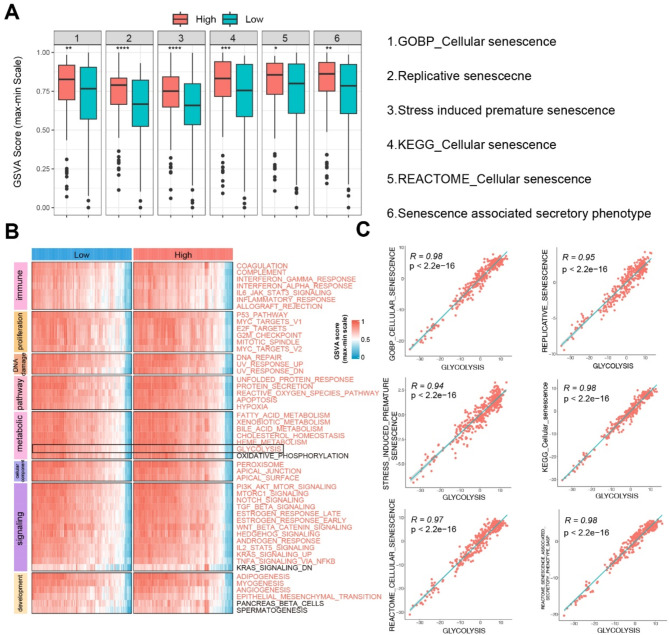
图4
5、TGFBI信号在GBM细胞的细胞衰老中起重要作用
为了进一步筛选衰老GBM细胞中上调糖酵解的关键调节因子,交叉了GBM与正常脑组织之间的共同DEGs、预后CSRG和糖酵解相关基因。如图5a所示,TGFBI被确定为衰老GBM细胞糖酵解的关键调节因子。IHC、western blot和RT-PCR检测表明,与正常脑组织相比,TGFBI在GBM组织中高表达(图5B-D)。与人星形胶质细胞(HA)相比,GBM细胞系(U87/U251)始终表现出TGFBI的显著上调(图5E和F)。为了探索TGFBI在GBM细胞衰老中的作用,通过转染shRNA敲低U87和U251细胞中的TGFBI(图5G和H)。如图5I和图J所示,与对照组(sh-NC)相比,TGFBI敲低显著降低衰老标志物P53和P16。为了进一步验证TGFBI在衰老中的作用,测试了阿霉素诱导的衰老GBM细胞中β-半乳糖苷酶活性的存在。如图5K和L所示,SA-β-gal活性测定进一步表明TGFBI沉默后显著降低。这些结果表明,TGFBI促进了GBM细胞的衰老。
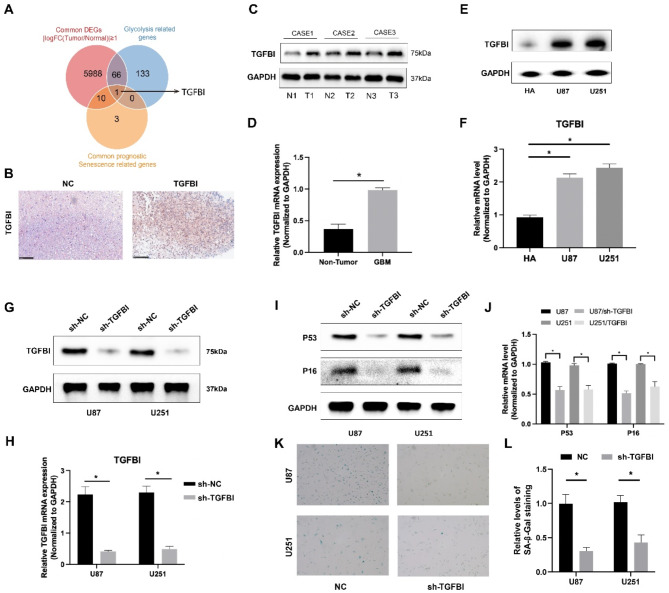
图5
6、TGFBI促进GBM细胞的糖酵解和化疗耐药
由于糖酵解在衰老的胶质母细胞瘤(GBM)细胞中显著上调,进一步探究了TGFBI在GBM细胞糖酵解中的作用。如图6A-C所示,与阴性对照(sh-NC)相比,敲低TGFBI(sh-TGFBI)抑制了葡萄糖摄取,减少了乳酸生成,并降低了细胞内ATP水平。OCR检测表明,TGFBI基因敲低会损害线粒体呼吸,基础呼吸和maximum呼吸减弱证明了这一点(图6D-F、J-L)。同时,ECAR测量证实,与sh-NC组相比,sh-TGFBI细胞的糖酵解通量减弱,糖酵解和糖酵解能力均显著降低(图6G-I、M-O)。总之,上述结果表明,TGFBI促进了GBM细胞的糖酵解。如图6P所示,与sh-NC相比,TGFBI基因敲低增强了药物疗效,降低了替莫唑胺的半数抑制浓度(IC50)值。这一结果表明,TGFBI促进了GBM细胞的化学抗性。
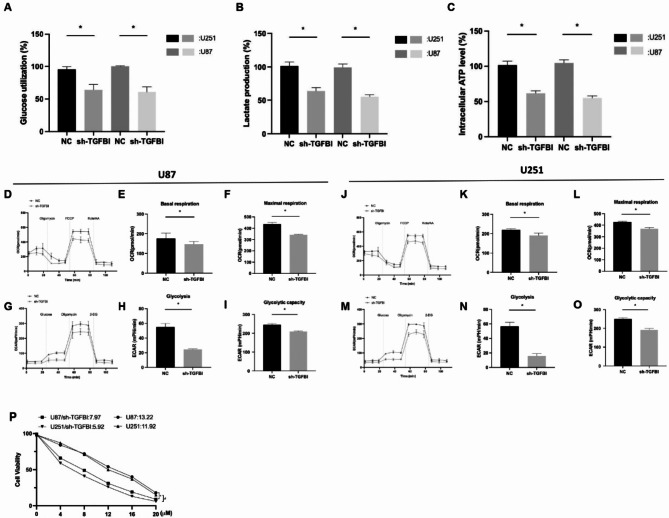
图6
7、STAT3转录调节GBM细胞中TGFBI的表达
进一步探究了胶质母细胞瘤(GBM)中TGFBI上调的潜在机制。如图7A和C所示,与正常脑组织相比,GBM组织中的TGFBI和STAT3显著增加。此外,TGFBI与STAT3之间存在强正相关(图7B和D)。此外,在GBM细胞系中敲低STAT3显著降低了TGFBI蛋白和mRNA水平(图7E-G)。为了研究转录调控,利用JASPAR数据库在TGFBI启动子中鉴定出一个STAT3结合位点(图7H)。染色质免疫沉淀(ChIP)结果显示,STAT3占据了TGFBI启动子(图7I),而荧光素酶报告基因检测表明,TGFBI的转录激活依赖于STAT3(图7J和K)。总体而言,这些结果表明,在GBM中STAT3作为TGFBI的转录调节因子发挥作用。
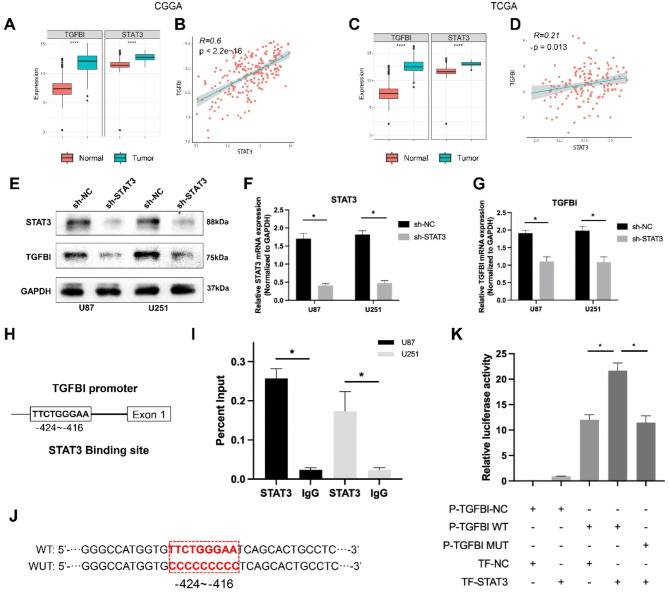
图7
8、TGFBI参与STAT3诱导的GBM细胞衰老
先前的研究已确定STAT3是细胞衰老的关键调节因子。基于这些发现,研究了TGFBI在STAT3诱导的衰老中的作用。如图8A-D所示,STAT3敲低显著导致衰老相关标志物P53和P16死亡。然而,这种效应可以通过过表达TGFBI来部分逆转。此外,STAT3敲低显著消除了衰老GBM细胞中SA-β-gal染色,而TGFBI的过表达显著逆转了这种减少(图8E和F)。
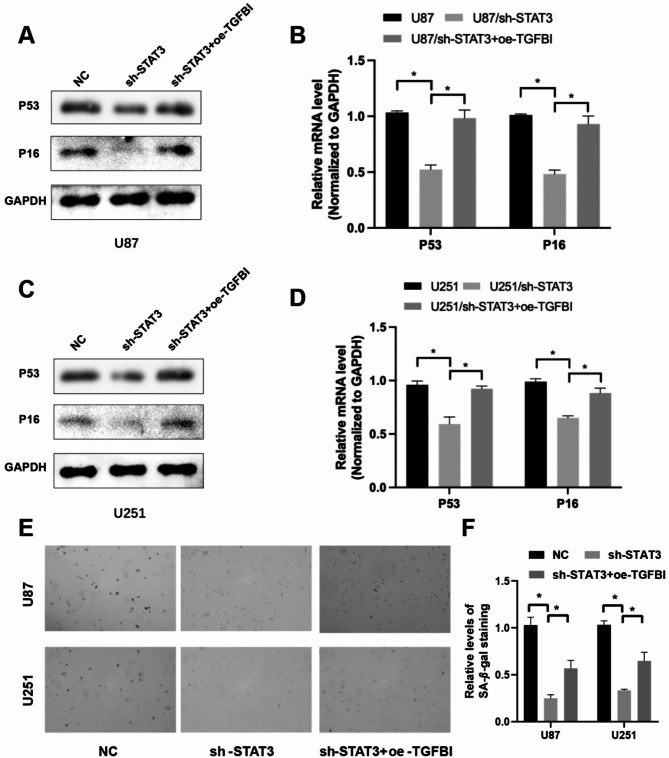
图8
10、TGFBI参与STAT3诱导的GBM细胞糖酵解和化疗耐药
STAT3调节驱动肿瘤进展和治疗抗性的糖酵解代谢过程。为了研究TGFBI在GBM细胞中STAT3介导的糖酵解中的作用。检测了U87和U251细胞中的葡萄糖利用、乳酸生成和细胞内ATP水平。如图8A-F所示,与阴性对照(NC)组相比,STAT3敲低(sh-STAT3)显著降低了葡萄糖消耗、乳酸输出和ATP水平,而TGFBI过表达部分挽救了这些影响。接下来,通过检测耗氧率(OCR)评估线粒体氧化呼吸。与NC对照组相比,sh-STAT3组的线粒体呼吸降低,包括基础呼吸和maximum呼吸降低(图9G-I和M-O)。TGFBI过表达抵消了这些代谢改变。此外,进一步进行细胞外酸化率(ECAR)分析以证实STAT3-TGFBI在糖酵解调节中的作用。如图9J-L和P-R所示,糖酵解通量和糖酵解能力被STAT3敲低所抑制,但在TGFBI过表达时恢复。
最后,探究了TGFBI在胶质母细胞瘤(GBM)细胞中STAT3介导的化学抗性中的作用。如图9S和9T所示,STAT3基因敲低显著增强了U251和U87细胞系对药物的反应,而TGFBI过表达则逆转了这种效应。
11、NF-κB可与STAT3-TGFBI协同作用
由于替莫唑胺(TMZ)耐药机制复杂且存在相互作用,进一步确定了其他与STAT3-TGFBI轴协同作用以促进TMZ耐药的调节因子。如图10A所示,与正常脑组织相比,胶质母细胞瘤(GBM)组织中NF-κB亚基P65、P50、P52和RELB显著增加。此外,NF-κB亚基与STAT3之间存在强正相关(图10B)。鉴于NF-κB调节主要的STAT3激活剂IL-6的转录,NF-κB可能与STAT3-TGFBI协同作用以促进TMZ耐药。
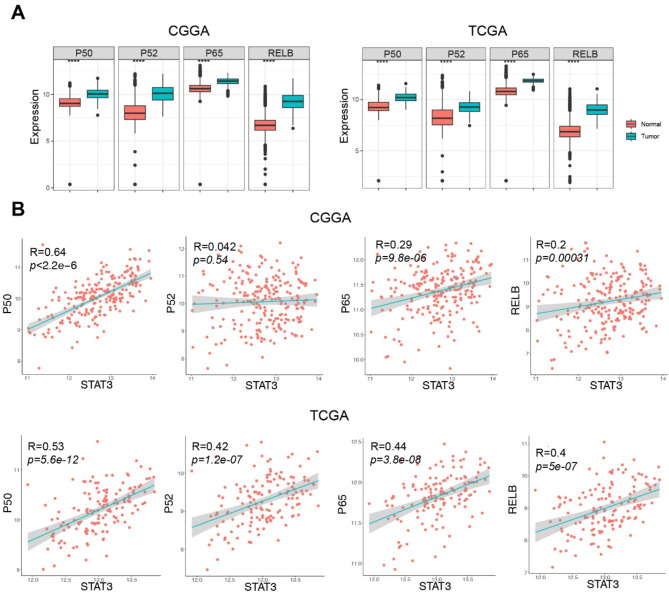
图10
总结:研究通过机器学习构建GBM衰老相关基因预后模型,发现STAT3调控TGFBI诱导细胞衰老和糖酵解,增强替莫唑胺耐药性,揭示STAT3-TGFBI轴可作为GBM衰老靶向治疗新靶点。傲星生物深耕生信分析十余载,有丰富的实验方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




