IF:6.7,网络药理学+机器学习!内容详实,堪称发文模板!
题目:解毒三根汤抗结直肠癌的生物活性成分:一种新颖、全面的天然药物开发研究策略
英文名:Bioactive components of Jiedu Sangen decoction against colorectal cancer: A novel and comprehensive research strategy for natural drug development
杂志:Phytomedicine
影响因子:6.7
发表时间:2025年4月21日
研究背景:结直肠癌(CRC)发病率和死亡率高,传统中药解毒三根汤(JSD)临床疗效显著但活性成分未知。中药复方成分复杂,需结合多技术解析其作用机制,推动天然药物开发。
研究思路:通过UPLC-MS/MS筛选JSD入血成分及代谢物,结合RNA-seq、网络药理学、机器学习(AHP-SOM算法)筛选关键活性成分与靶点,利用分子对接、分子动力学模拟及实验(SPR、MST)验证相互作用,阐明其抗CRC机制。
研究结果:
1、JSD显著抑制结直肠癌细胞体外增殖
JSD干预SW620细胞48小时和72小时的半数抑制浓度(IC50)如图1A所示,因此后续实验的浓度梯度设定为0.5mg/ml、1mg/ml、2mg/ml和3mg/ml。平板克隆实验证实,2mg/ml和3mg/ml的JSD可有效减少SW620细胞的增殖(如图1B和C所示)。不同浓度梯度JSD干预SW620细胞7天的增殖曲线也证实了上述观点(如图1D所示)。流式细胞术检测细胞凋亡和EdU实验也证实,随着JSD浓度的增加,对SW620细胞增殖的抑制作用更加明显(如图1E、F和H所示),图片统计结果如图1G和I所示。

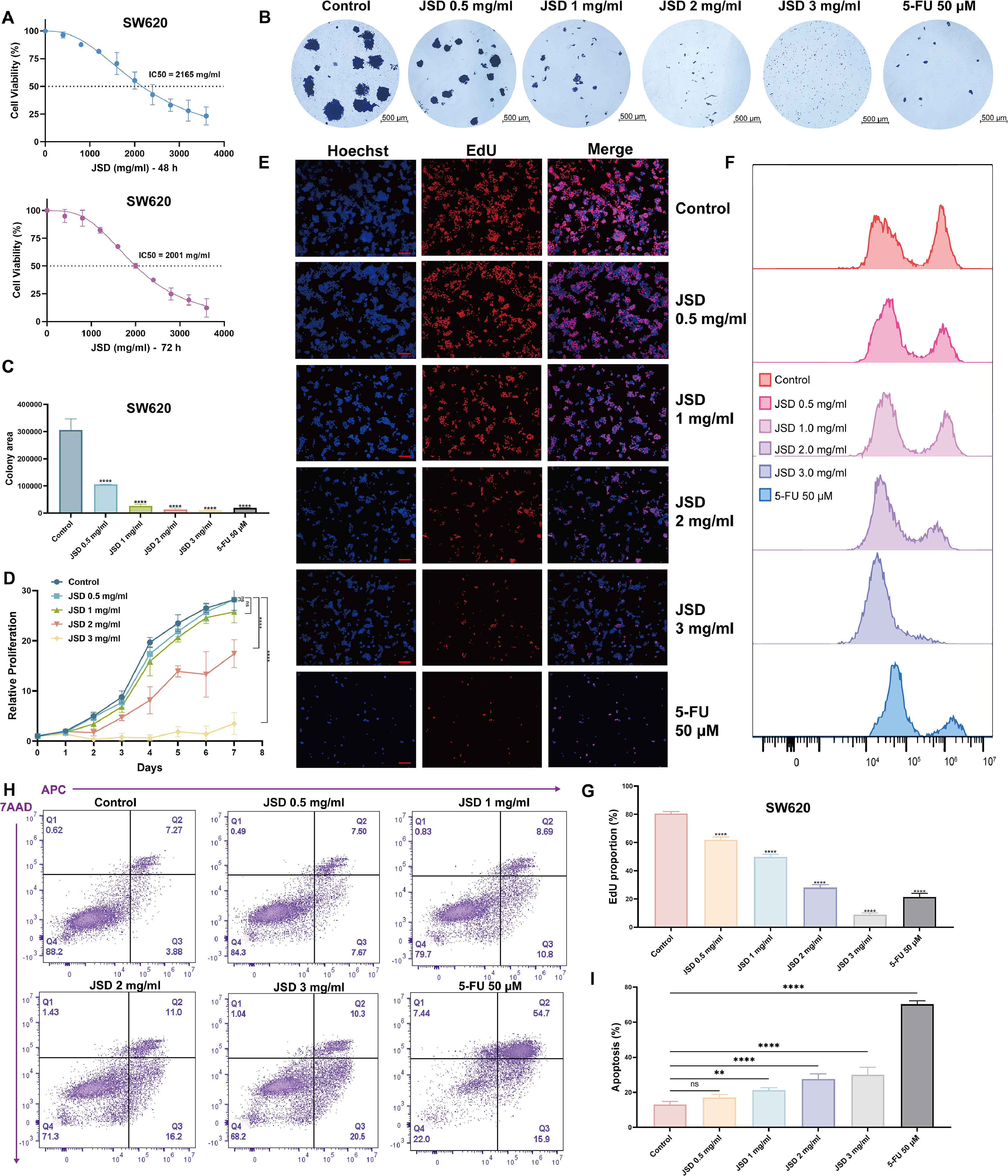
图1
2、JSD化学成分谱的表征
鉴于中药复方所含物质的复杂性,使用UPLC-MS/MS对JSD进行高通量成分分析是天然药物开发的具体体现。图2A和B分别显示了JSD在正离子和负离子模式下的总离子流图(TIC),鉴定出的主要峰标记为1-102。典型的化合物碎片模式如图2C和D所示。
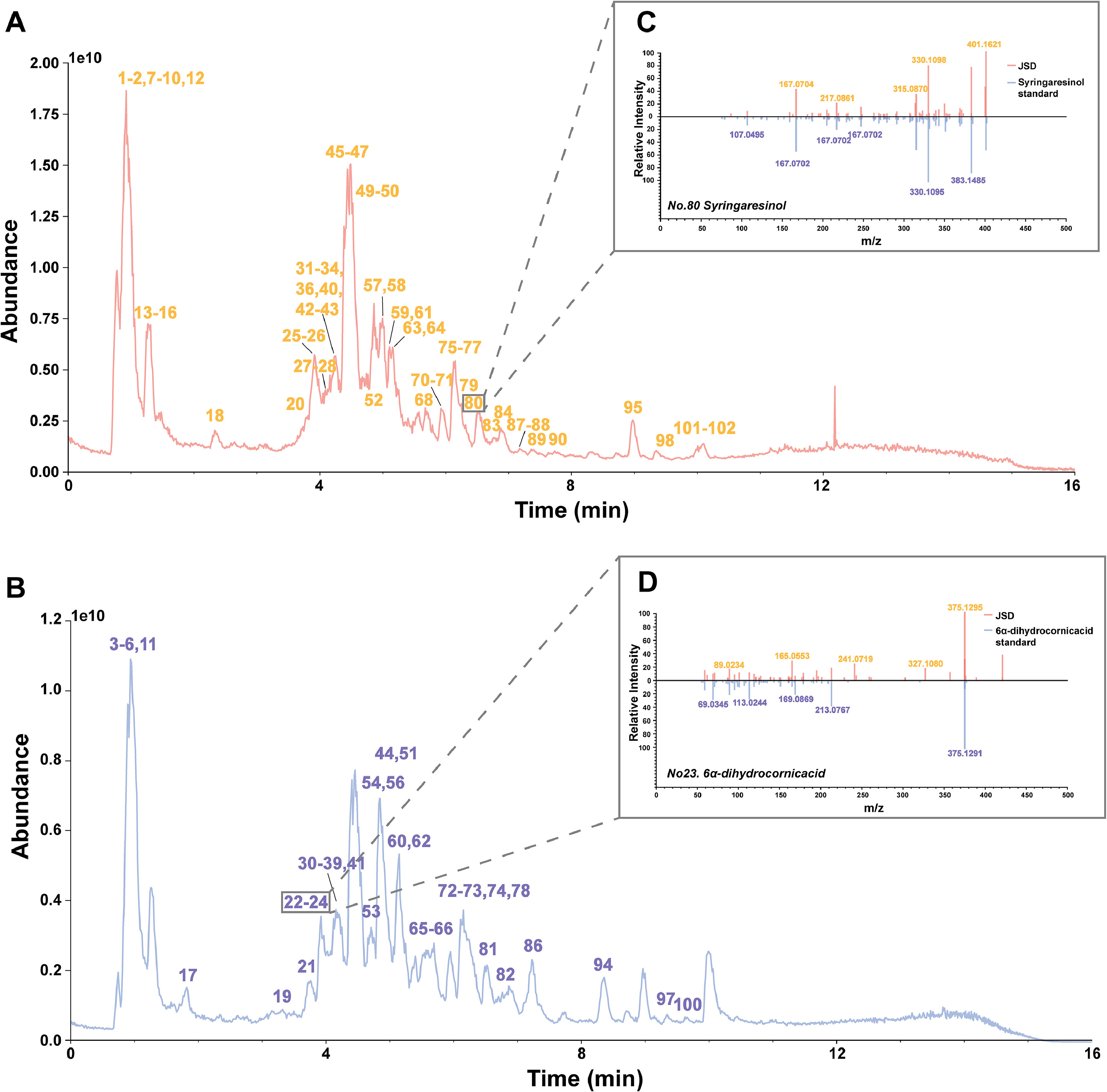
图2
3、JSD成分在大鼠血浆中的检测与表征
如图3所示,空白血浆、含药血浆和JSD的TIC存在显著差异,表明仅通过表征水煎液的成分来解释中药复方的疗效是片面的。共鉴定出18种原型成分和8种可能的代谢物,包括4种黄酮类、5种萜类、5种苯丙素类、3种酚类、2种蒽醌类和7种其他成分。

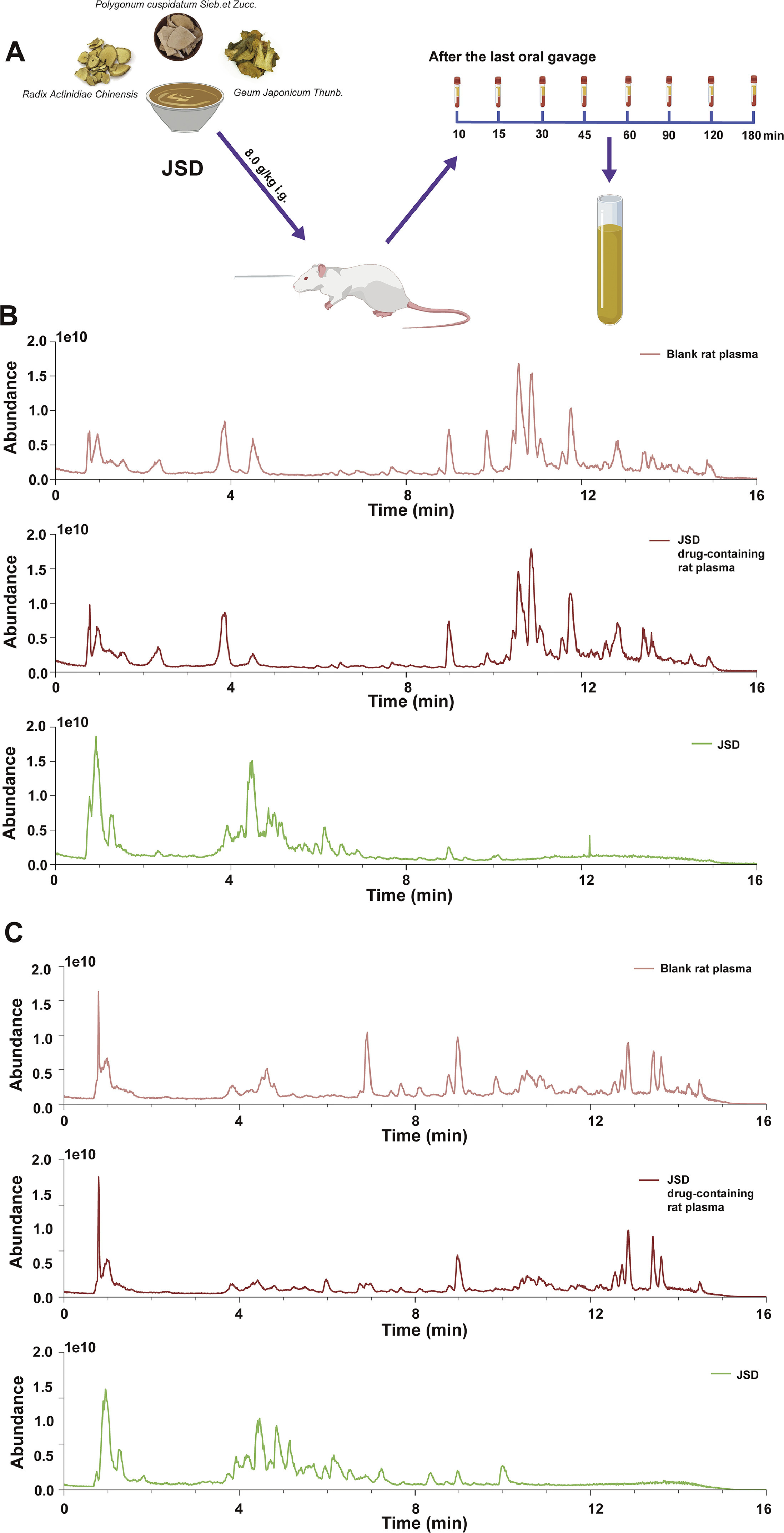
图3
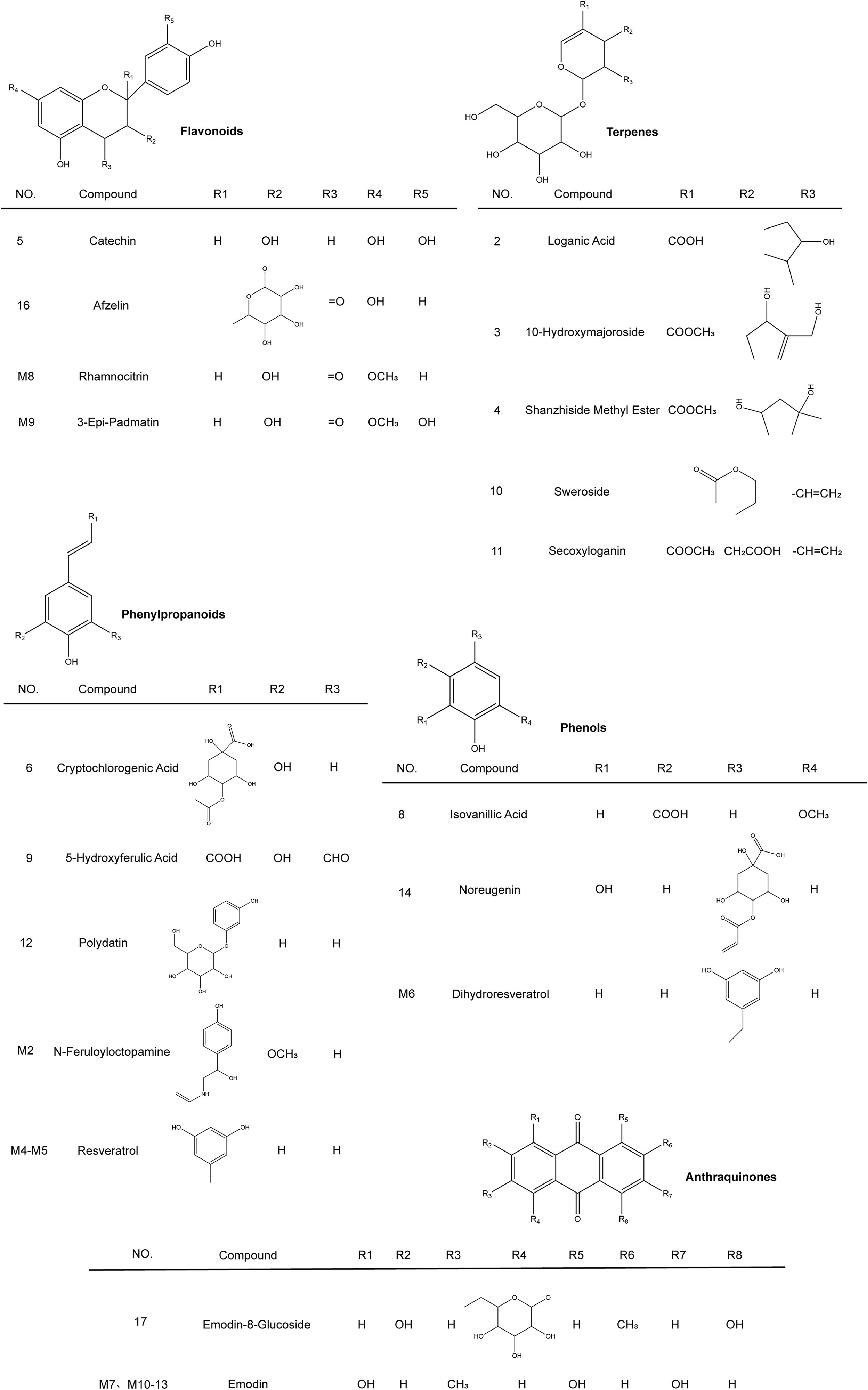
图4
4、RNA-seq分析JSD干预结直肠癌细胞的综合表征
对JSD干预后的SW620细胞进行RNA-Seq分析,获得了183个上调的mRNA和235个下调的mRNA(图5a)。对差异表达基因进行GO、KEGG和GSEA富集分析,发现它们集中在多个与结直肠癌相关的信号通路,如PI3K-Akt信号通路、Wnt信号通路、Hippo信号通路,以及凋亡、免疫反应、脂质运输和铁离子结合等生物学过程和分子功能(图5B-D)。功能聚类分析发现,差异表达的mRNA集中在跨膜运输、T细胞增殖和凋亡的负调控(图5E)。热图和GO富集分析表征了JSD干预SW620细胞后变化的非编码RNA(图5F-H)。进一步进行共表达分析,以阐明JSD干预后差异表达的编码和非编码基因之间的相关性(图5I)。

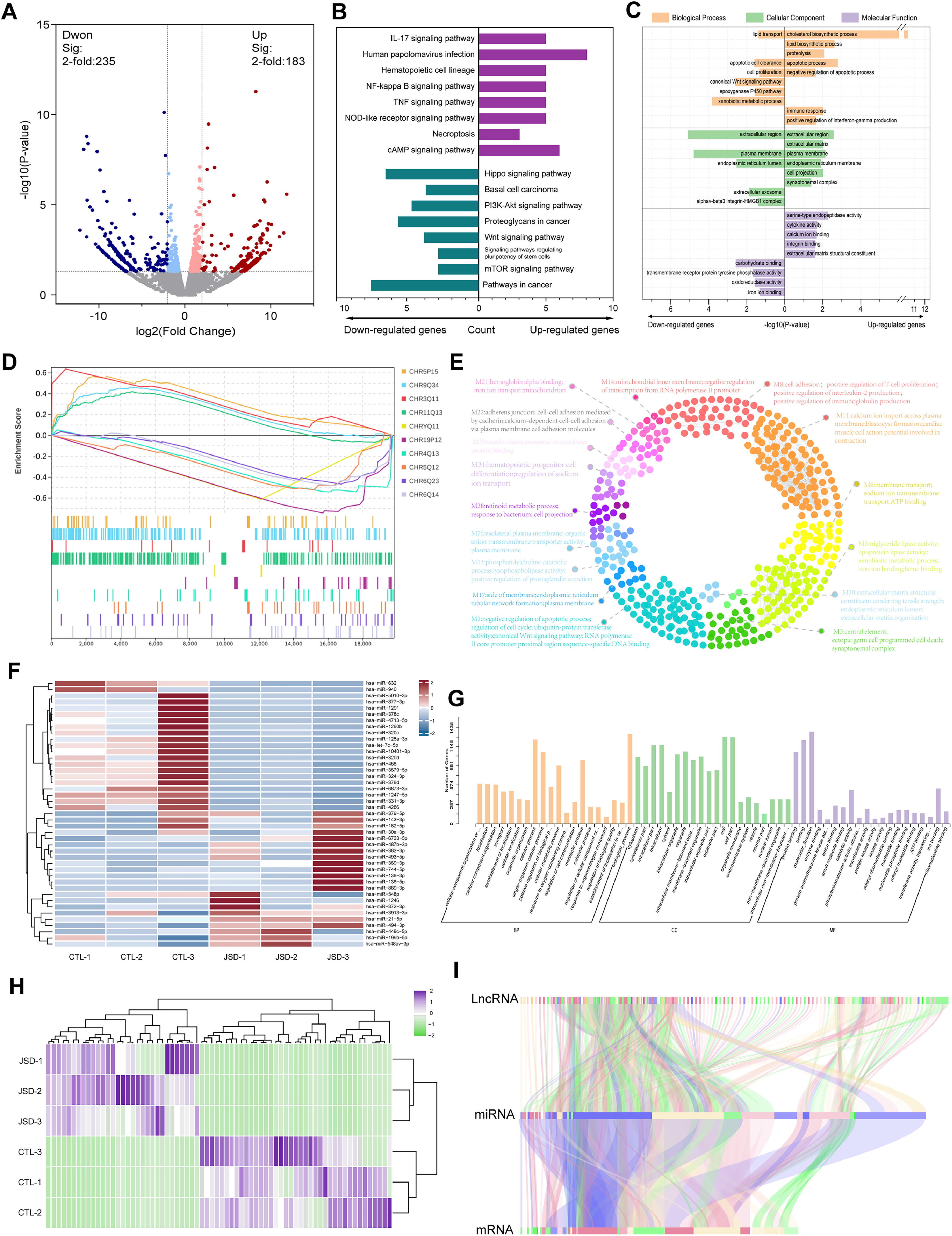
图5
5、网络药理学分析JSD生物活性成分抗CRC的潜在靶点和机制
基于TCGA和GTEx数据库,获得了11,326个结直肠癌和正常组织中的差异表达基因。然后,结合TCMSP、Pubchem、SwissTarget等数据库,获得了JSD的18种入血成分和8种可能代谢物的1372个潜在靶点。取上述两者的交集,获得了JSD生物活性成分抗CRC的232个潜在靶点(图6A)。对上述232个靶点进行网络分析和可视化(图6B)。对上述可能的靶点进行GO和KEGG富集分析,发现它们集中在炎症反应、凋亡和中性粒细胞趋化等生物学过程。这些靶点作用于细胞外区域、细胞膜、内质网和染色体等多个细胞区域(图6C)。它们显著富集在PI3K/Akt信号通路、氮代谢等信号通路(图6D)。绘制了JSD-活性成分-潜在靶点-机制通路图(图6E),为后续探索JSD抗CRC的有效生物活性成分及其分子生物学机制提供了方向。
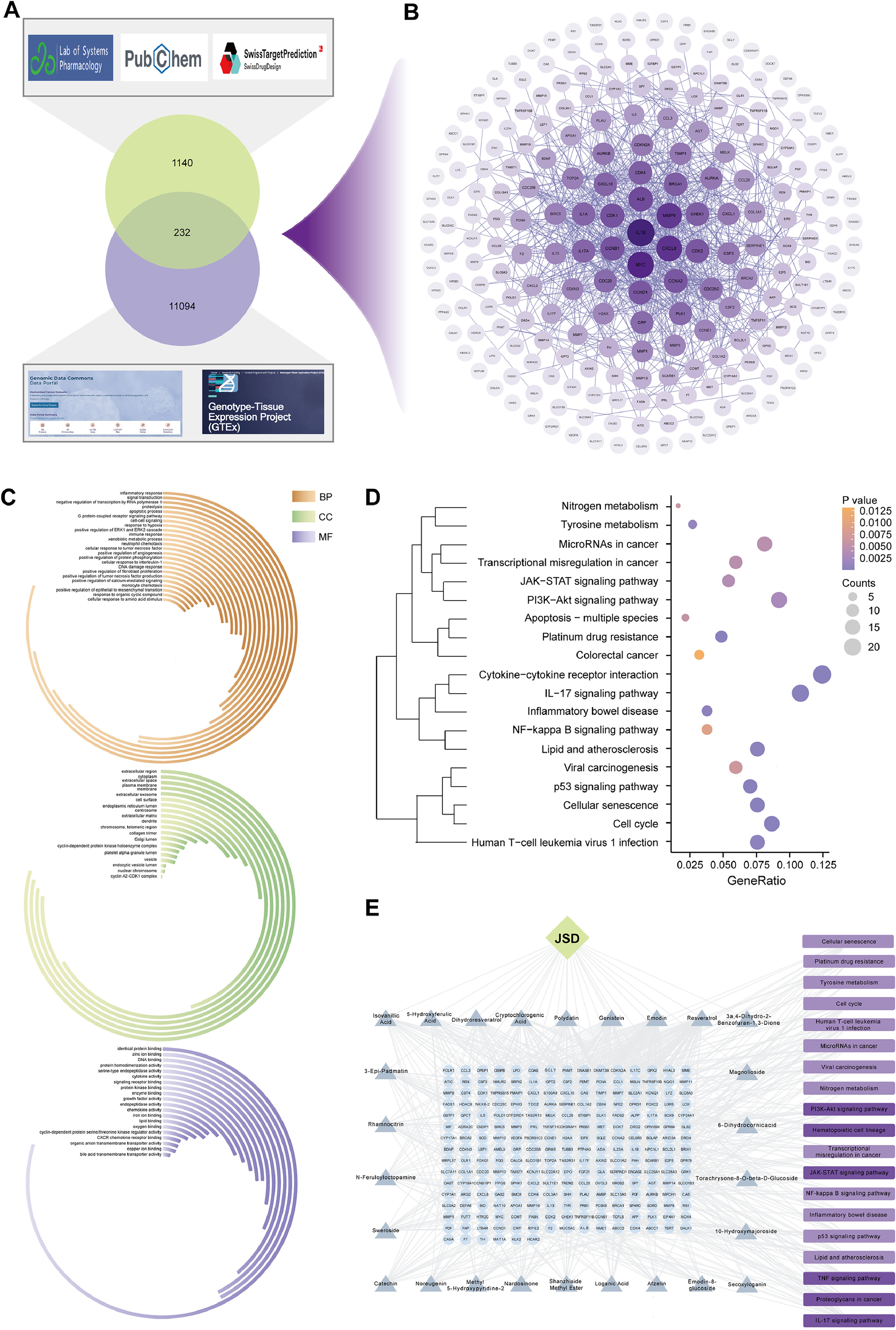
图6
6、生物信息学分析探索CRC关键靶点的生存预后及机器学习推导JSD核心生物活性成分
将获得的JSD生物活性成分抗CRC的232个潜在靶点与JSD干预SW620细胞后转录组测序获得的差异表达基因相结合,获得了6个关键靶点:CA9、DOK7、DPEP1、NOTUM、CALB2和AKAP12(图7A)。对TCGA、GTEx和HPA数据库的分析显示,CA9、DOK7、DPEP1和NOTUM在CRC中上调,而CALB2和AKAP12在CRC中下调(图7B和C)。JSD对6个靶点的调节如图S4B所示。使用HPA数据库对TCGA-COADREAD进行预后分析,发现关键靶点与患者的OS和PFI等预后密切相关(图7D)。同时,它们的表达还与CRC患者的TMN分期和CEA水平相关(图7E)。诊断ROC分析显示,关键靶点可有效指示CRC的发生(图7F)。接下来,分析了TCGA数据库中CRC患者中这6个关键靶点之间的相关性以及与免疫细胞浸润的相关性。AKAP12和CALB2之间、NOTUM和DPEP1之间存在较强的相关性(图7G)。总体而言,NOTUM、DPEP1、DOK7和CA9的表达增加伴随着各种免疫细胞的减少,而AKAP12和CALB2则观察到相反的现象(图7H)。JSD血浆中存在的26种生物活性成分与6个关键靶点的分子对接表明,大多数活性成分可能与关键靶点具有稳定的结合(图7I)。利用神经元之间的关系进一步验证,染料木黄酮、阿夫泽林和白藜芦醇是Most潜力的生物活性成分(图7J)。综上所述,获得了JSD最有希望的生物活性成分及其干预CRC的关键靶点(图7K)。

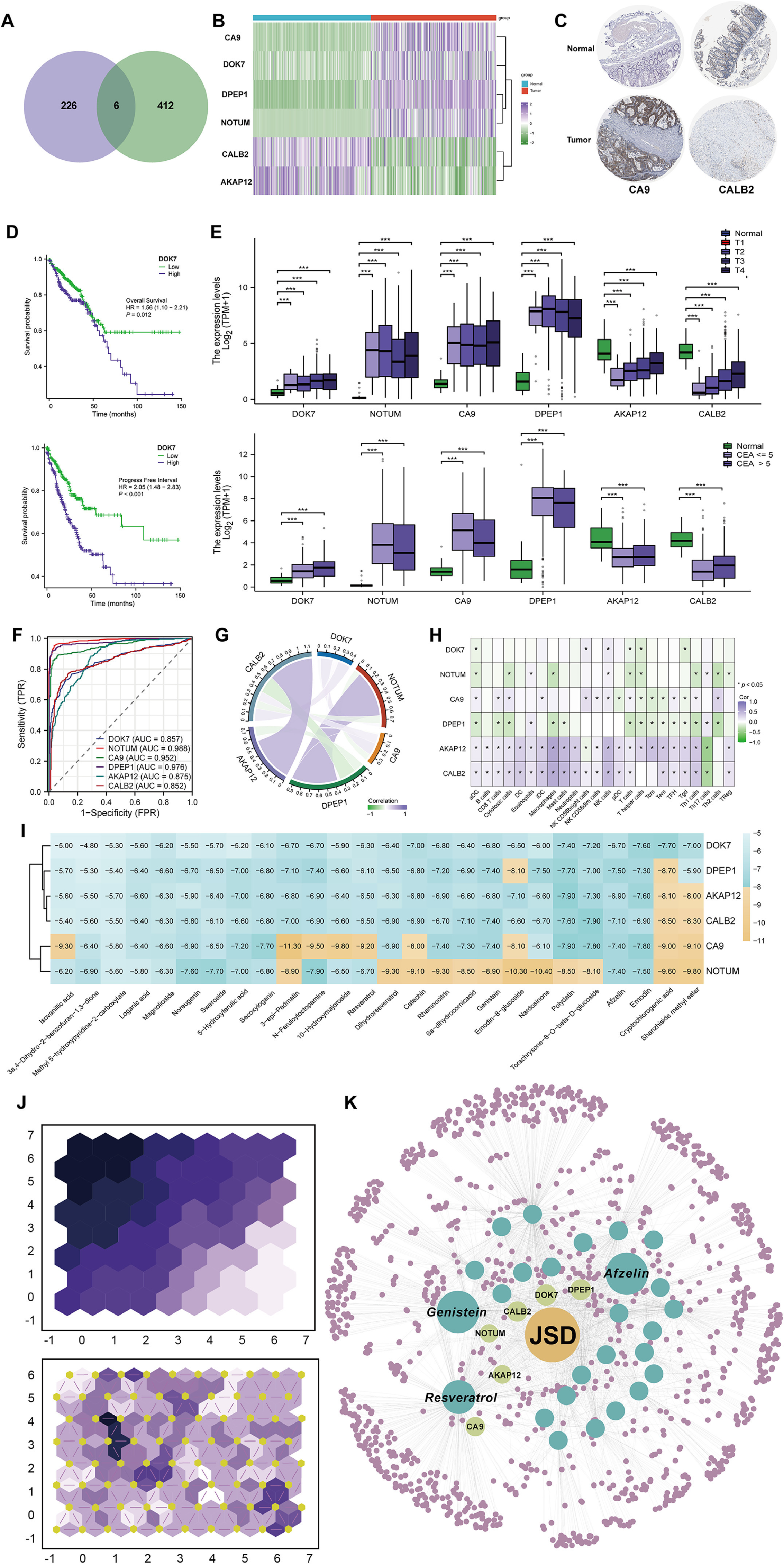
图7
7、核心生物活性成分与关键靶点的分子对接和分子动力学模拟及验证
图8A显示了机器学习获得的JSD的6个关键靶点与3个最有希望的生物活性成分之间的分子对接结合能。选择结合能minimum的三对“蛋白质-小分子”复合物进行后续的分子动力学模拟和实验验证(黄色圆圈表示)。图8B-D是6个关键靶点最稳定结合位点的示意图。
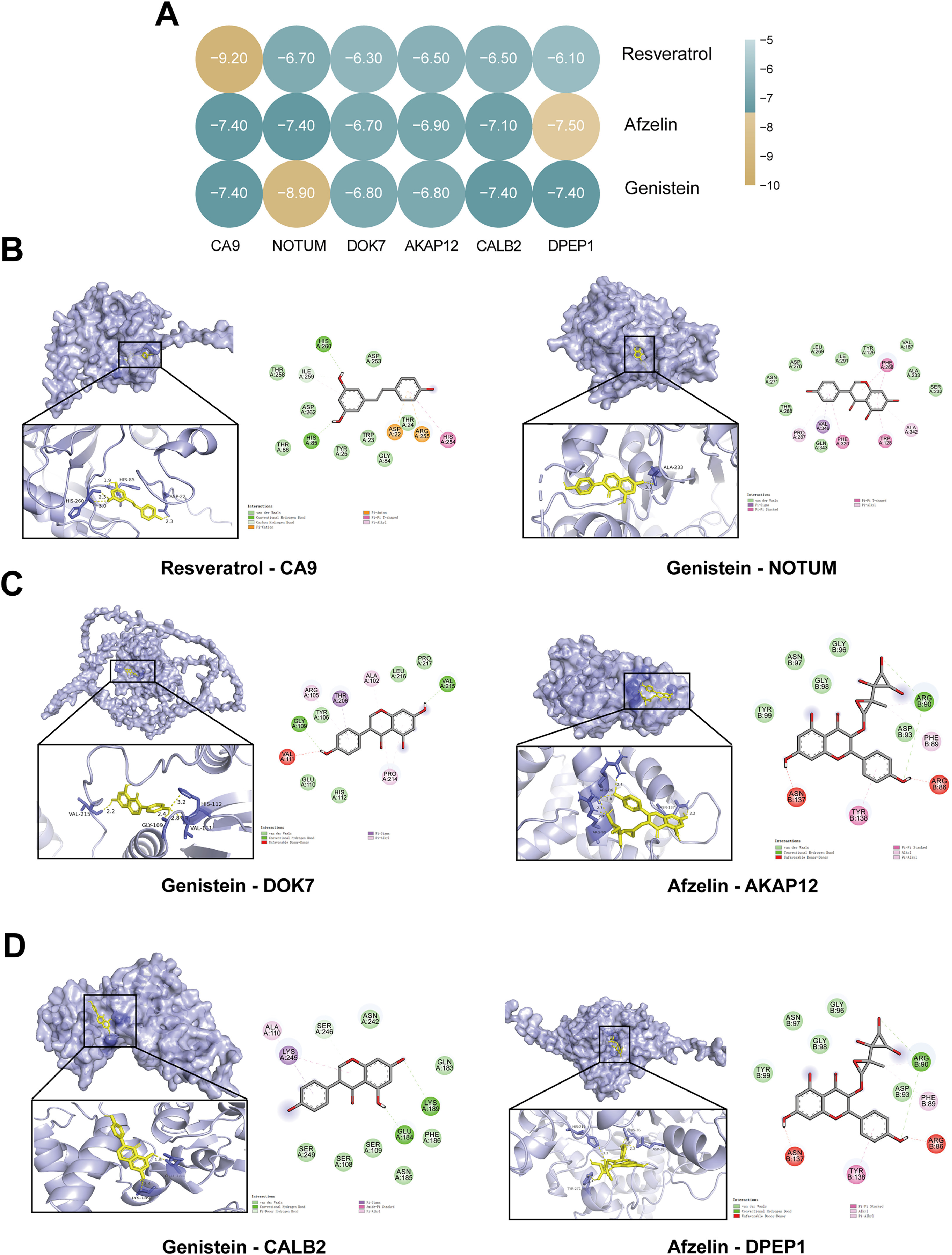
图8
染料木黄酮-NOTUM、阿夫泽林-DPEP1和白藜芦醇-CA9均位于靶蛋白的结合位点,并在模拟过程中表现出良好的进入模式(图9A和B,图10A和B,图11A和B)。例如,白藜芦醇的芳香环渗透到CA9的疏水核心区域;染料木黄酮的双酚环与NOTUM进入结合口袋;阿夫泽林的糖苷部分面向DPEP1的极性残基,苯环嵌入疏水核心。总能量为负表明复合物在热力学上趋于稳定。阿夫泽林-DPEP1复合物的范德华能为-40kcal/mol,表明强疏水相互作用支持结合的稳定性(图9C,图10C和图11C)。CA9的关键残基(如Leu、ARG等)对范德华力和静电能有显著贡献,反映了这些残基在结合位点稳定性中的作用(图9D)。NOTUM蛋白中的氨基酸残基对能量有显著贡献,这些残基有助于增强染料木黄酮的结合稳定性(图10D)。
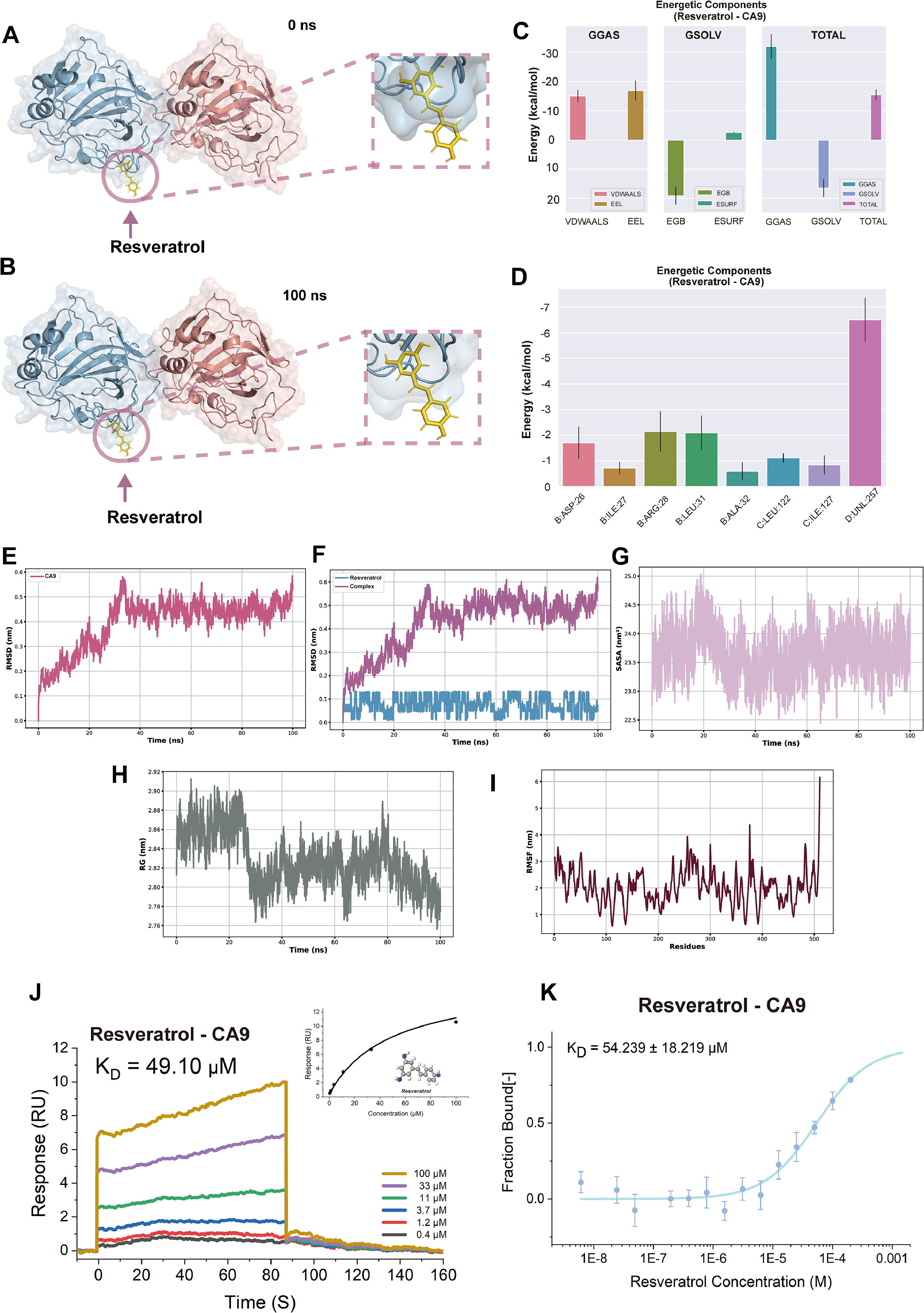
图9
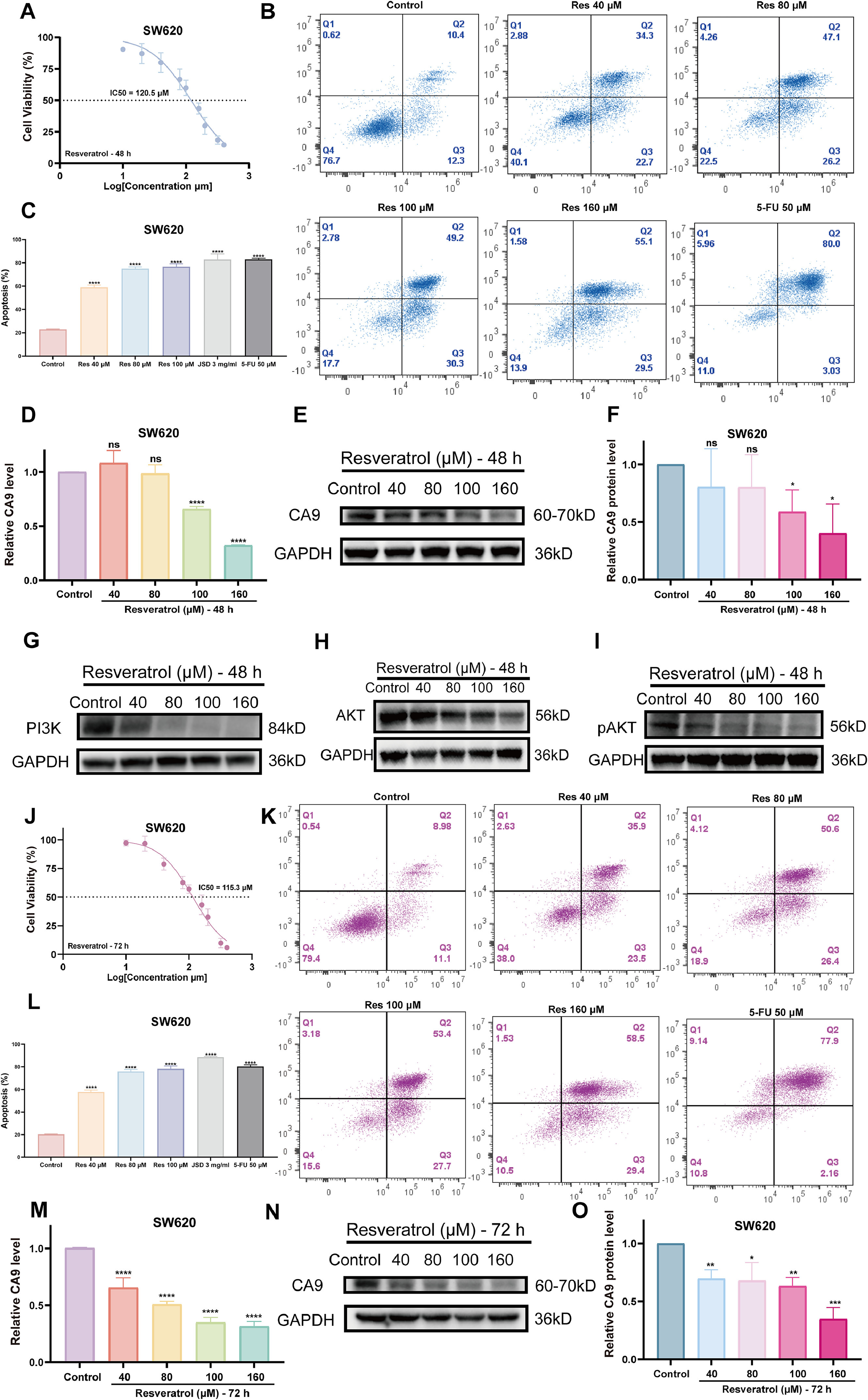
图10
DPEP1中的疏水残基和极性氨基酸对能量有显著贡献,表明蛋白质与阿夫泽林之间结合紧密(图11D)。RMSD、SASA、Rg和RMSF分析表明,三种小分子(白藜芦醇、染料木黄酮、阿夫泽林)在相应的蛋白质结合位点表现出稳定的结合能力,结合后未诱导蛋白质的全局构象变化。靶蛋白整体保持稳定结构,结合位点在结合后表现出良好的适应性调整(图9E-I,图10E-I和图11E-I)。此外,使用SPR和MST技术评估分子动力学模拟的准确性。SPR实验具有明显的结合信号,拟合结果在浓度梯度范围内,表明结合具有特异性(图9J,图11J和图13R)。MST拟合曲线呈“S”形,具有明显的上下平台和强浓度依赖性,表明结合具有特异性(图9K,图11K和图13S)。
JSD的三种最有希望的生物活性成分对SW620细胞的杀伤作用及其对各自关键靶点的mRNA和蛋白质水平的抑制作用呈剂量依赖性和时间依赖性趋势(图10A-C,图10J-L,图12A-C,图12G-I和图13J-M)(图10D-F,图10M-O,图12D-F,图12J-L,图13K-L和图13N-Q)。结合上述KEGG富集通路结果,对白藜芦醇和染料木黄酮干预后的SW620细胞进行相应的WB实验,初步证明白藜芦醇可能通过CA9/PI3K/AKT通路促进CRC细胞凋亡,染料木黄酮可能靶向NOTUM下调b-catenin表达抑制CRC细胞增殖(图10G-H和图12M-N)。上述所有结果证明了研究策略揭示JSD抗CRC的“黑箱”理论的可行性,并为小分子药物的开发提供了全方位的支持。
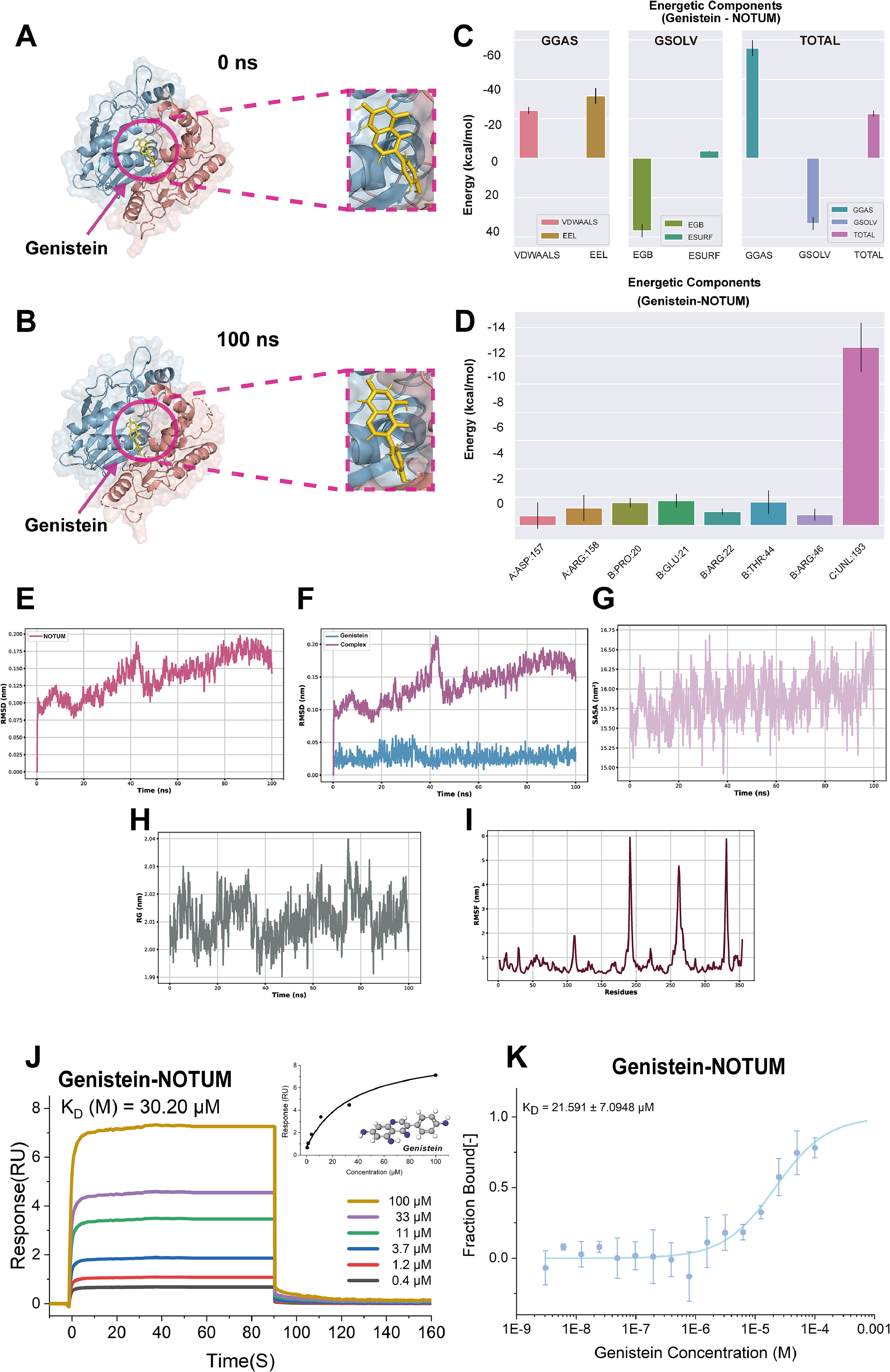
图11
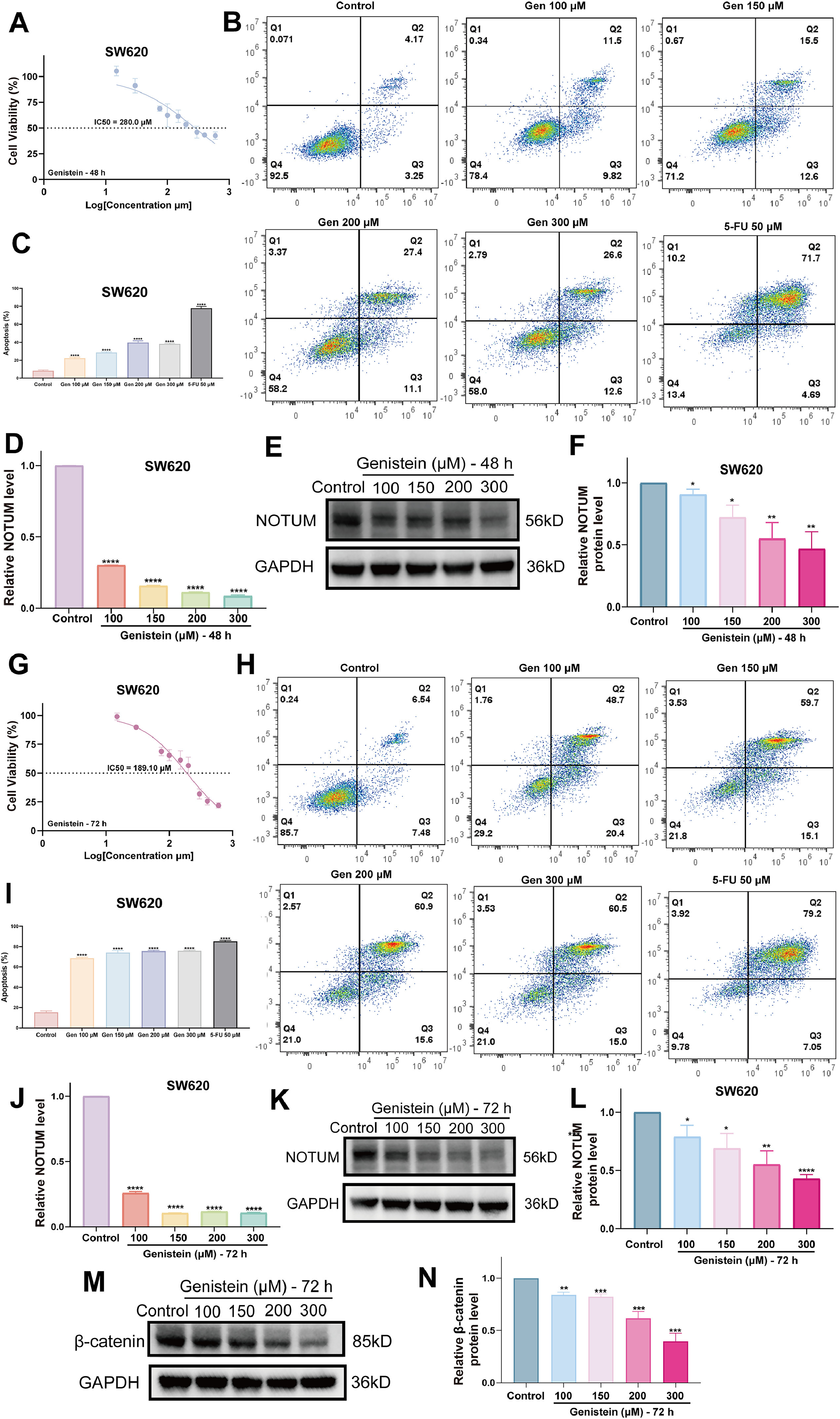
图12
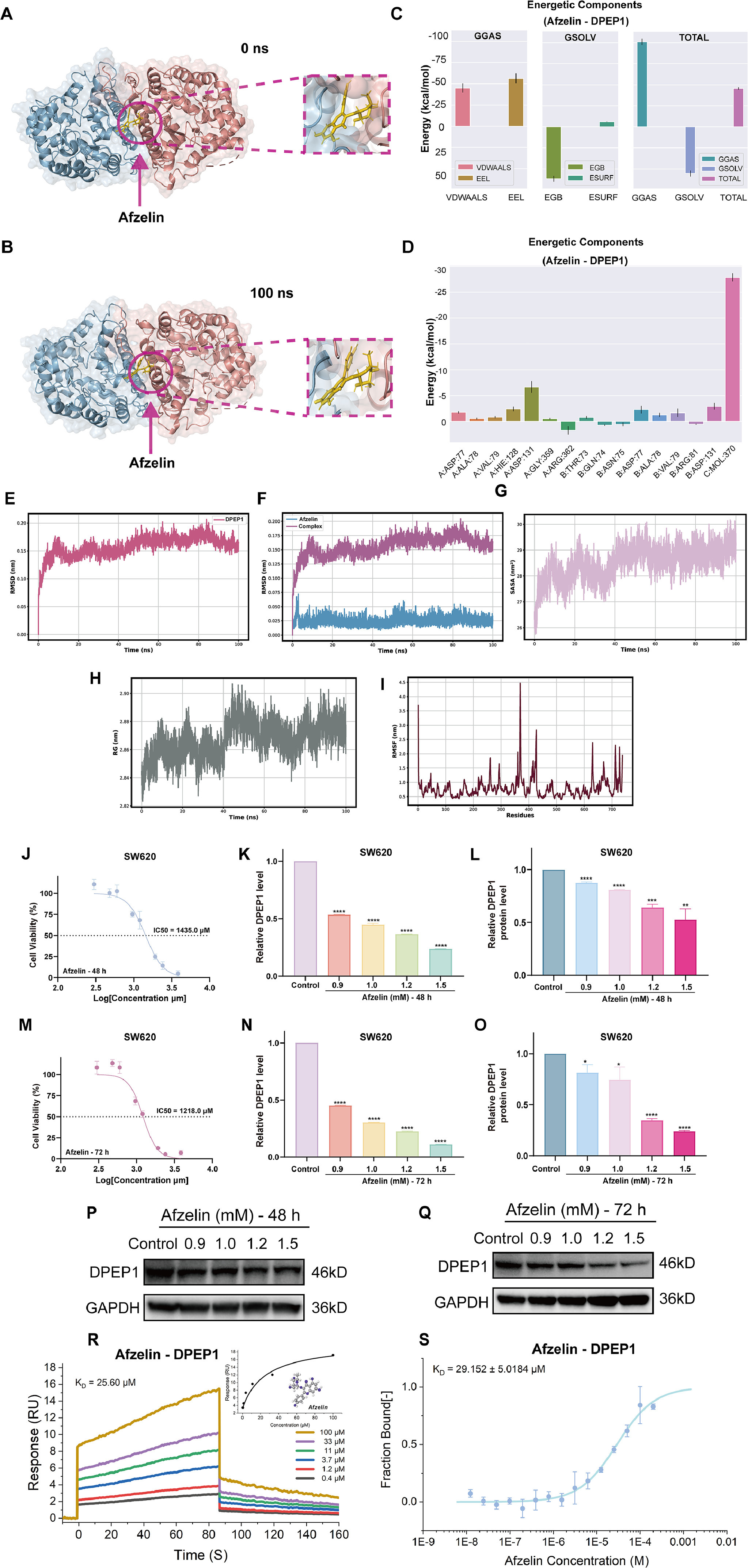
图13
总结:本研究建立了一种新颖的综合研究策略,鉴定出JSD的核心活性成分为白藜芦醇、染料木素和阿夫泽林,靶点为CA9、NOTUM和DPEP1,并揭示其通过调控PI3K/AKT和β-catenin信号通路发挥抗CRC作用,为天然药物开发提供了新方向。傲星生物深耕生信分析十余载,有丰富的实验方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




