IF:6.7,“千年古方焕发新生!网络药理学揭示黄芪郁金抗癌核心靶点HIF-1α”!
题目:黄芪郁金通过HIF-1α调控肿瘤血管正常化抑制结肠癌转移
英文名:Astragali Radix-Curcumae Rhizoma normalizes tumor blood vessels by HIF-1α to anti-tumor metastasis in colon cancer
杂志:Phytomedicine
影响因子:6.7
发表时间:2025年2月24日
研究背景:肿瘤血管异常通过加剧缺氧微环境、抑制免疫功能等方式促进肿瘤转移。黄芪(补气药)与郁金(活血药)的组合(AC)具有抗肿瘤转移作用,但其调控肿瘤血管正常化的机制尚不明确。
研究思路:通过结肠癌原位移植小鼠模型,结合网络药理学、分子生物学技术(如WB、IF、ELISA等),验证AC通过靶向HIF-1α抑制糖酵解关键酶PFKFB3,增强血管内皮连接,促进血管正常化,最终抑制肿瘤转移。
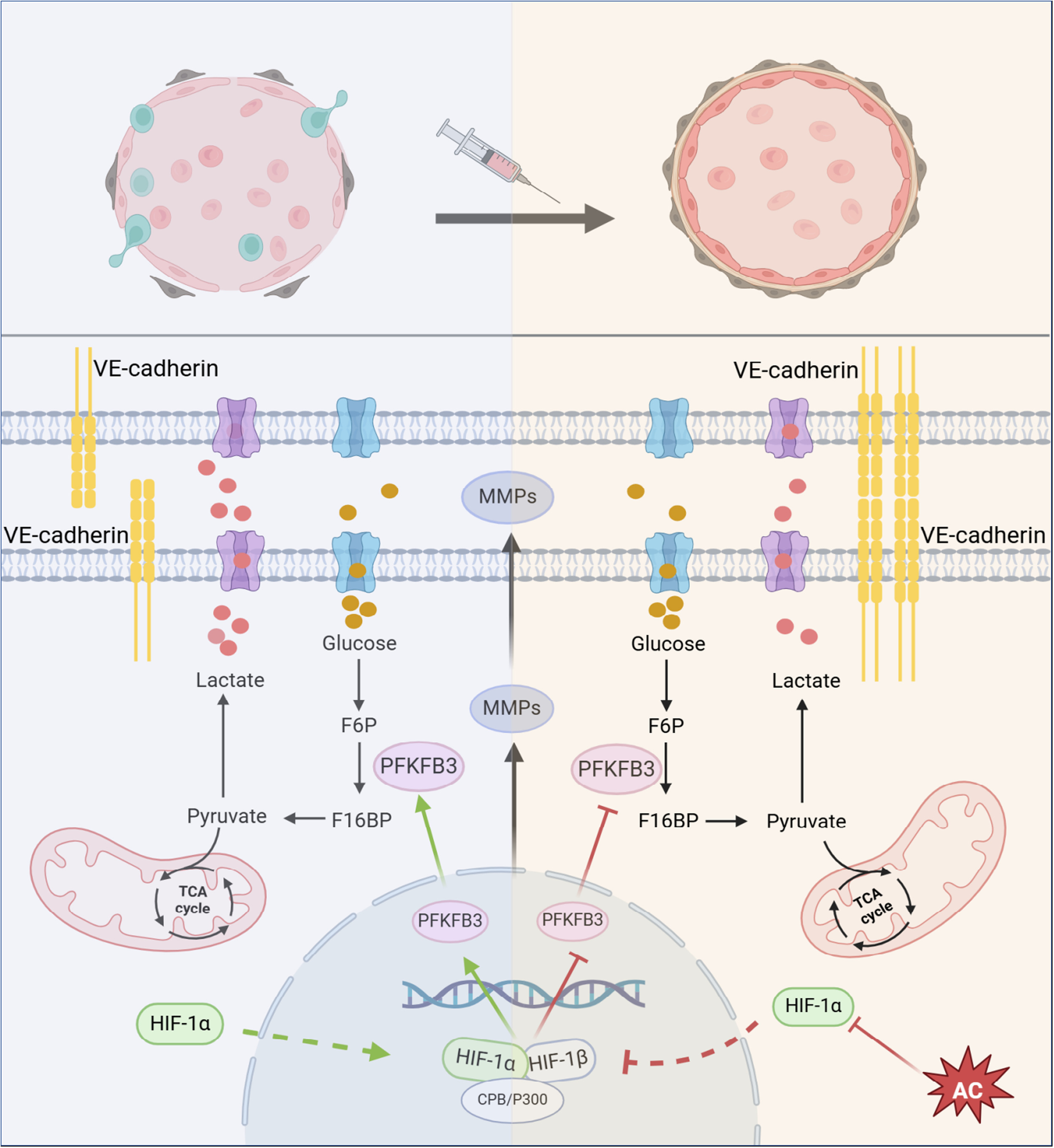
图1

研究结果:
1、AC对肿瘤负荷小鼠肿瘤生长和肝转移的抑制作用
与模型组(Model)相比,5-Fu组和高剂量AC组(AC-high)的相对生物发光强度显著降低(图2C,D),表明5-Fu和AC-high能有效抑制肿瘤生长。肿瘤体积(图2E-G)和Ki67染色结果进一步支持了这一结论,显示药物干预组的肿瘤增殖率显著降低(图2H,I)。H&E染色显示,模型组的肿瘤组织细胞核密集,而药物干预组的肿瘤细胞分布显示出坏死区域,部分细胞核缺失(图2J)。
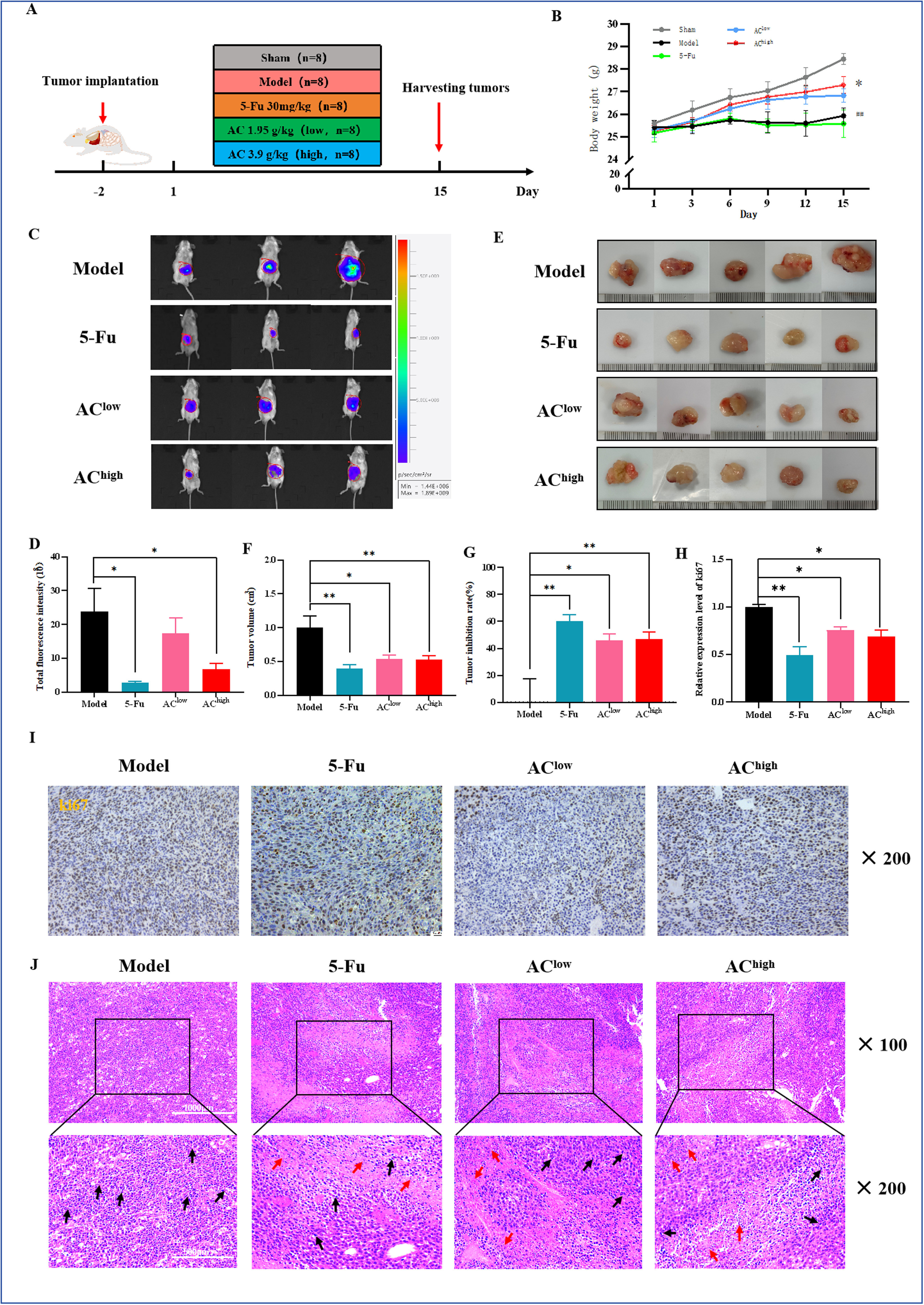
图2
2、AC对肿瘤转移的抑制作用
解剖后观察到肝脏上的白色结节,手动计数确定肝转移的数量。结果显示,模型组小鼠的肝脏显示出明显的转移迹象,而5-Fu和AC-high治疗后,肝转移结节的数量显著减少(图3A,B)。H&E染色进一步证实了转移灶核染色的变化(图3C)。WB分析显示,与假手术组相比,模型组中MMP9、N-cadherin和vimentin的表达水平显著升高,而AC给药后这些蛋白的表达水平降低(图3D,E)。

图3
3、AC改善肿瘤血管结构和功能,促进血管正常化
扫描电子显微镜观察结果显示,药物干预后,肿瘤相关内皮细胞(TECs)之间的连接紧密,细胞间间隙减小,形态趋于扁平(图4A)。α-SMA和NG2染色结果表明,AC干预后,血管平滑肌细胞和周细胞的覆盖显著增加。此外,IV型胶原蛋白(Col-IV)的覆盖也显著增强,表明基底膜的支持改善(图4B,C)。如预期,AC干预组中肿瘤血管的lectin阳性染色面积显著增加(图4D,E),且AC干预显著减少了周围血管的dextran渗漏,表明血管通透性降低(图4D,E)。VE-cad在增强内皮细胞连接中起关键作用,qRT-PCR分析显示AC干预后VE-cad表达增加。WB分析进一步评估了VE-cad在细胞膜上的分布,结果显示,与假手术组相比,模型组中细胞膜上的VE-cad表达水平显著降低,而AC给药后VE-cad表达水平相对升高(图4F-H)。
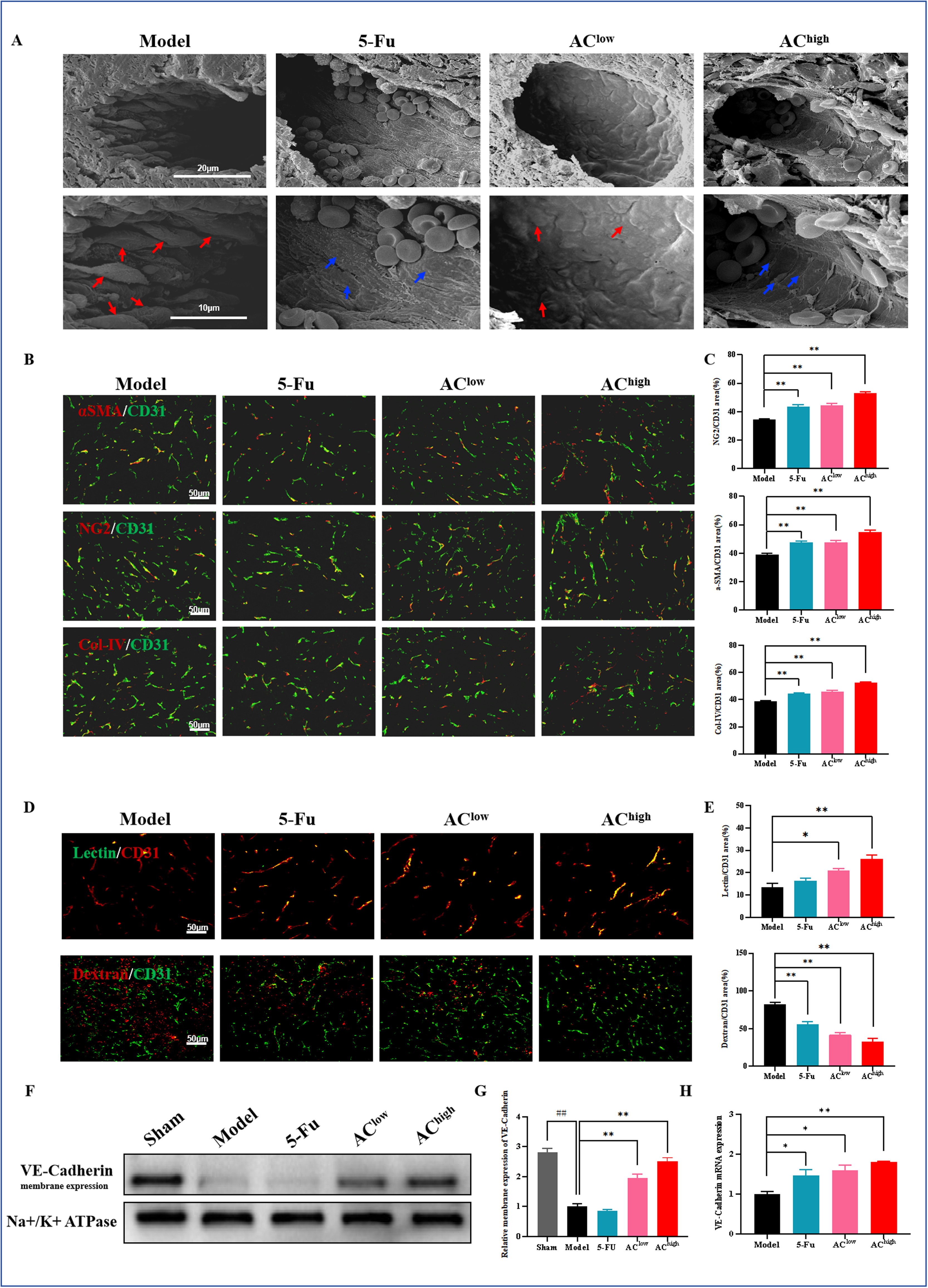
图4
4、 AC通过结合HIF-1α并抑制其核转位来改善缺氧微环境
网络药理学分析表明,AC可能通过改善缺氧微环境来促进肿瘤血管正常化。通过RNA测序数据,研究了AC干预是否能通过改善缺氧微环境来促进肿瘤血管正常化。共鉴定出611个与结直肠癌(CRC)相关的靶点和684个与AC相关的靶点。通过在线工具Venny2.1.0,确定了172个与AC相关的抗CRC靶点(图5a)。这些蛋白的相互作用(PPI)从STRING数据库获得,并在Cytoscape3.7.2中构建了PPI网络(图5B)。基于“degree”值选择了前40个关键靶点,进一步进行KEGG富集分析和“成分-靶点-通路”网络的构建(图5C)。KEGG分析显示,主要信号通路包括PI3K-Akt、FoxO和HIF-1(图5D,E)。基于这些发现,我们重点关注HIF-1α,这是该信号通路的核心靶点。成分-靶点-通路网络表明,AC的主要成分通过这些关键靶点和通路发挥作用,包括槲皮素(A2)和山柰酚(A15)(图5C)。
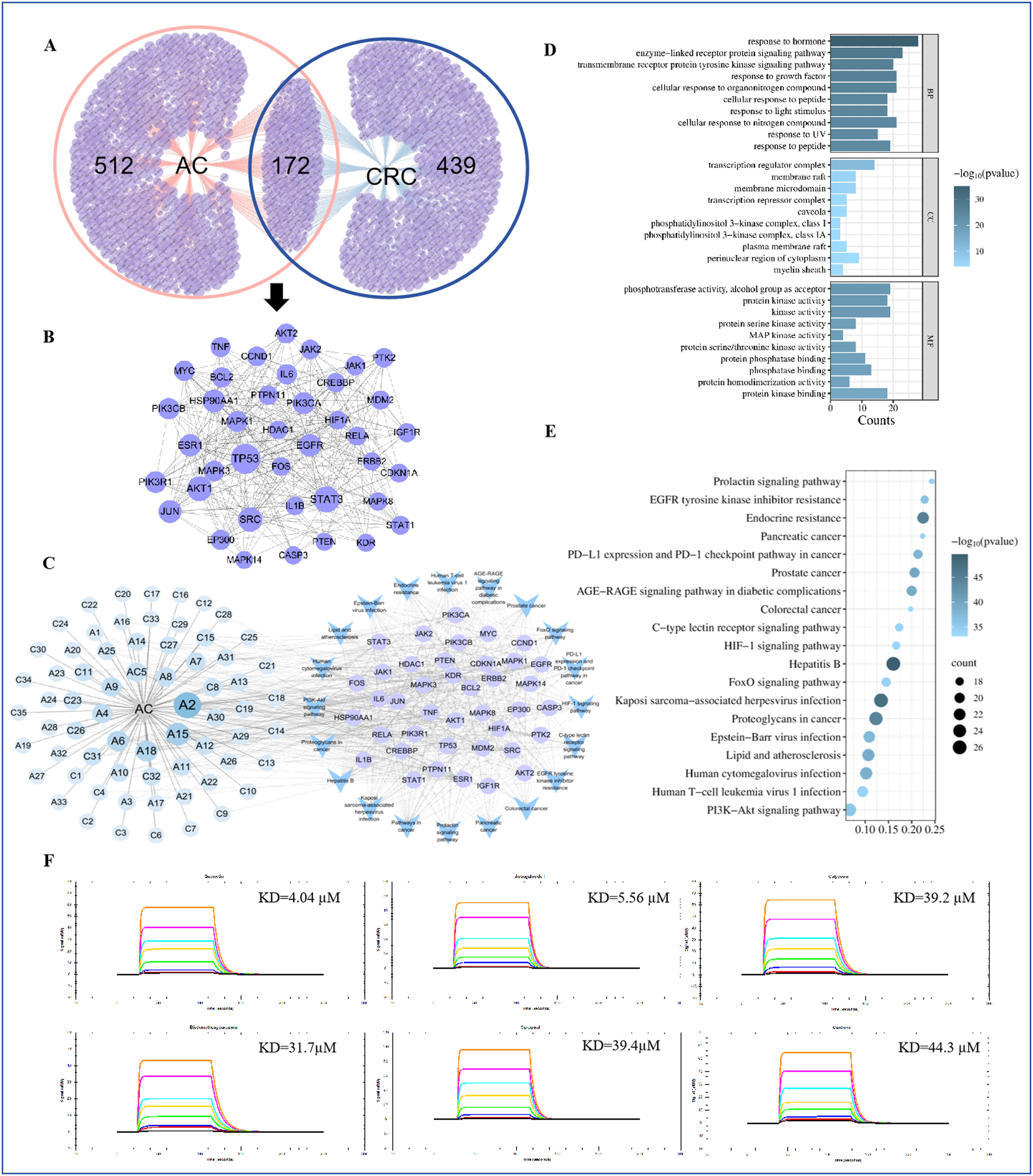
图5
5、AC的核心成分与HIF-1α的有效结合
将重组HIF-1α蛋白固定在葡聚糖传感器芯片上。基于网络药理学的发现,我们选择了潜在的核心活性成分,如槲皮素和山柰酚,通过表面等离子共振(SPR)常数探索它们与HIF-1α的直接相互作用和亲和力。结果显示,槲皮素和山柰酚可以与HIF-1α直接结合,KD值分别为4.04×10⁶和3.39×10⁵(图5F)。
6、AC调节HIF-1α的表达并抑制其核转位,抑制糖酵解
HIF-1α仅在缺氧条件下稳定表达,允许其转位到细胞核并调节多种基因的转录。首先,我们对肿瘤组织中的HIF-1α进行IF染色,以评估各组肿瘤缺氧的程度。结果显示,药物干预减少了肿瘤组织中HIF-1α阳性区域的面积,改善了肿瘤的氧合(图6A,B)。qRT-PCR和WB分析进一步证实了这些发现(图6C,E,H)。进一步检查肿瘤组织中HIF-1α蛋白的核表达,结果显示,与假手术组相比,模型组中HIF-1α的表达水平显著升高,而AC给药后HIF-1α的核表达水平降低(图6C,E,H)。HIF-1α诱导多种代谢转化酶,使肿瘤代谢转向糖酵解。PFK-1是糖酵解的主要限速酶,由PFKFB产生的果糖-2,6-二磷酸激活,从而促进糖酵解。我们的结果显示,与假手术组相比,模型组中PFKFB3异常过表达,而药物干预后其表达水平显著下调(图6D,E,G)。我们测量了果糖-1,6-二磷酸水平,发现AC-high处理后该水平降低(图6H)。乳酸的产生是肿瘤细胞糖酵解率的主要指标。我们的研究发现,AC干预组的血清乳酸水平显著低于模型组(图6I)。

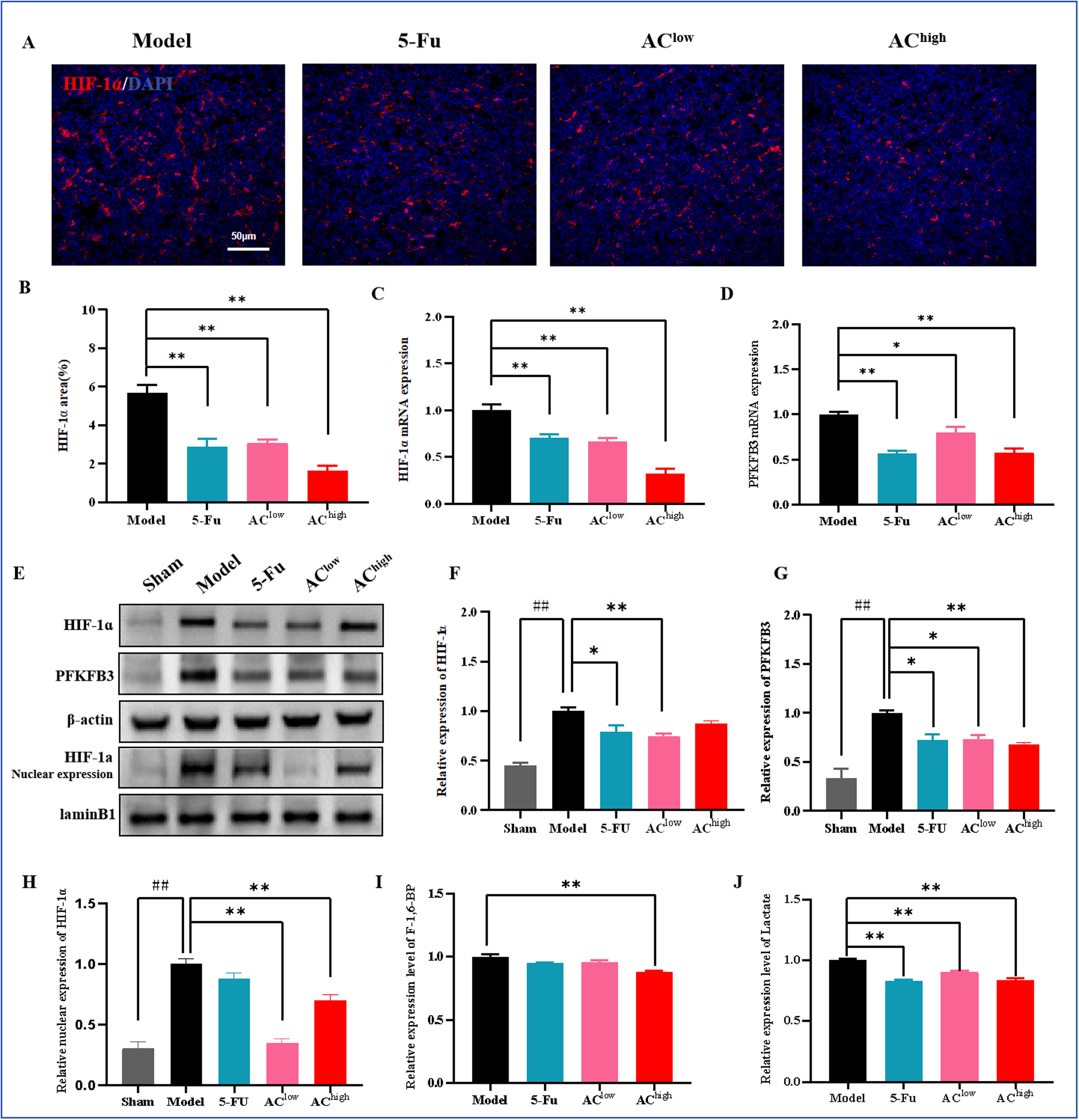
图6
7、AC通过HIF-1α改善缺氧微环境,延缓肿瘤进展
首先通过腹腔注射HIF-1α稳定剂DMOG来建立有效稳定和积累HIF-1α的小鼠模型。为了评估DMOG的效果,我们对各组小鼠肿瘤组织中的HIF-1α进行了IF染色。结果显示,与模型组相比,DMOG处理组中HIF-1α的阳性表达显著增加。此外,AC和DMOG联合干预后,HIF-1α的阳性率显著降低(图7H,I)。WB分析进一步证实了这些发现(图7J,K)。我们进一步研究了HIF-1α过表达对小鼠肿瘤生长和转移的影响,并比较了AC干预的效果。与模型组相比,DMOG刺激后肿瘤体积和重量增加。此外,在AC和DMOG联合组中,肿瘤体积和重量相较于DMOG单独组有所减少(图7C,D)。H&E染色显示,与DMOG单独组相比,AC和DMOG联合组的肿瘤细胞核排列稀疏,显示出明显的肿瘤坏死区域和细胞核缺失(图7E)。Ki67IHC染色的结果与这些发现一致(图7F,G)。
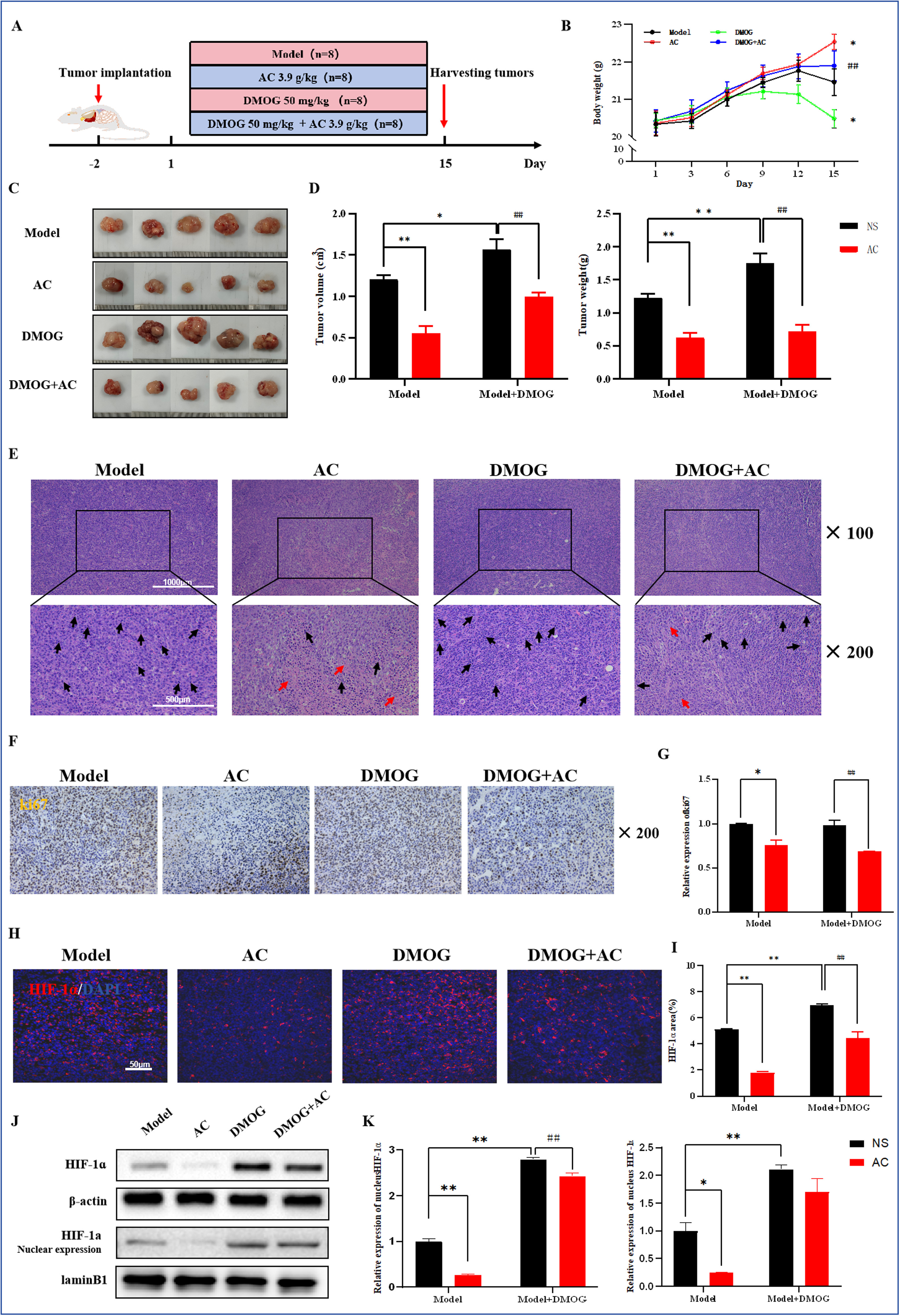
图7
8、AC抑制缺氧诱导的肝转移
与模型组相比,DMOG刺激后的肿瘤显示出更强的肝转移能力,而AC治疗抑制了缺氧诱导的肝转移(图8A,B)。H&E染色证实了这些发现(图8C),表明DMOG处理后肿瘤的肝转移增加。相反,在AC和DMOG联合干预组中,肝转移相较于DMOG单独组有所减少。
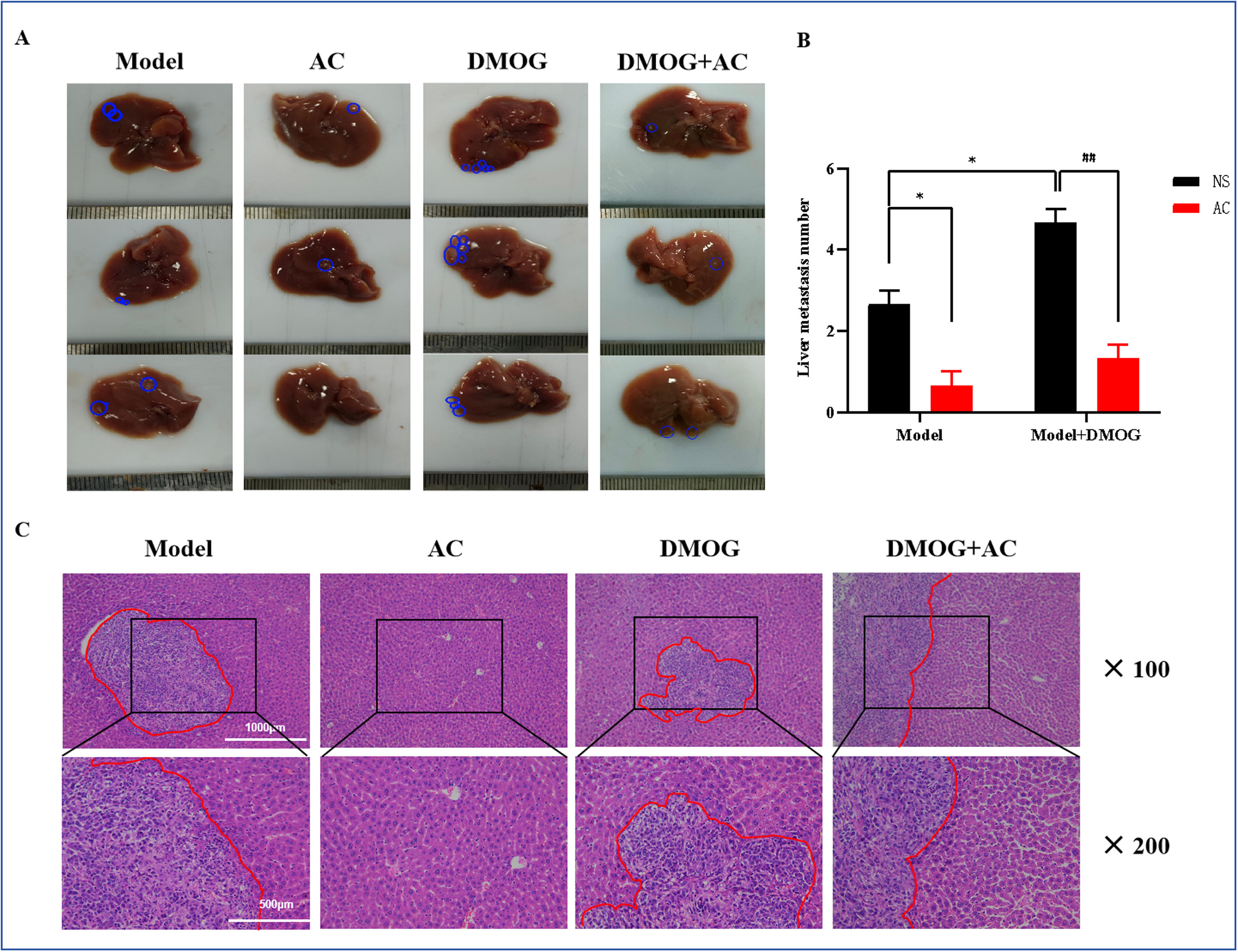
图8
9、AC通过HIF-1α促进肿瘤血管正常化并改善缺氧微环境
AC可能通过调节HIF-1α来影响肿瘤血管的结构和功能,从而抑制肿瘤转移。与模型组相比,DMOG刺激后,血管平滑肌细胞标记物αSMA、周细胞标记物NG2和基底膜标记物Col-IV的水平显著降低。此外,与DMOG单独组相比,AC和DMOG联合治疗组中血管平滑肌细胞、周细胞和基底膜的覆盖显著增强(图9A,B)。dextran渗漏实验结果显示,与模型组相比,DMOG建模后dextran外渗面积增加。重要的是,AC似乎恢复了HIF-1α过表达小鼠的血管通透性,从而抑制了渗漏(图9C,D)。此外,lectin灌注结果显示,与DMOG单独组相比,AC和DMOG联合组中lectin阳性信号面积增加,表明AC逆转了HIF-1α过表达的影响,并改善了这些小鼠的血液灌注(图9C,D)。
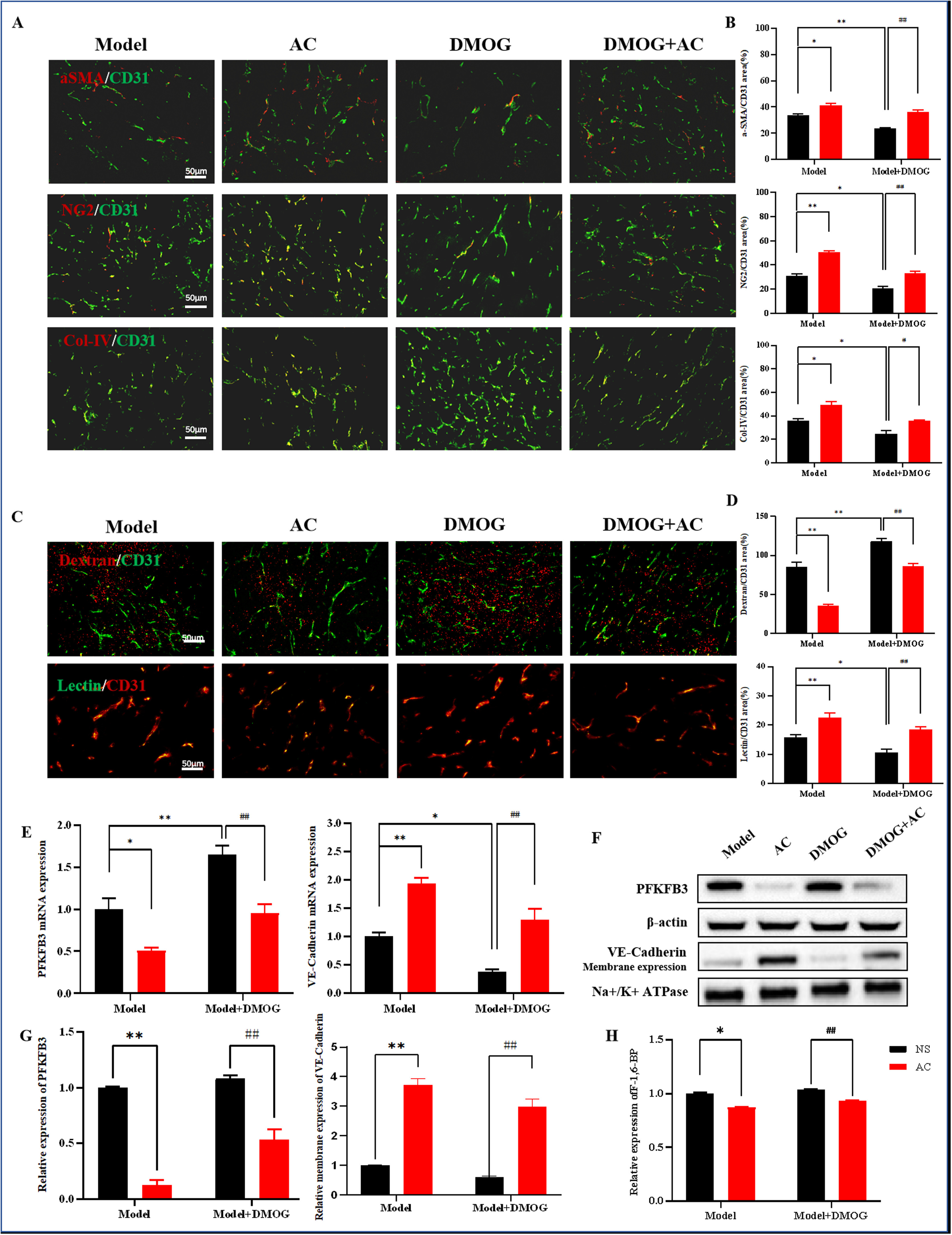
图9
10、AC通过HIF-1α抑制糖酵解,促进肿瘤血管正常化
AC可能通过调节HIF-1α和抑制糖酵解来影响肿瘤血管的重塑。观察结果显示,AC和DMOG联合组中PFKFB3的表达显著低于DMOG单独组(图9E-G)。此外,与DMOG单独组相比,AC和DMOG联合组中VE-cadherin的表达增加(图9E,G)。我们还注意到,HIF-1α的表达增加伴随着果糖-6-二磷酸浓度的相应增加。值得注意的是,AC降低了果糖-6-二磷酸浓度,AC和DMOG联合组相较于DMOG单独组果糖-6-二磷酸浓度显著降低(图9H)。
总结:本研究发现AC通过抑制HIF-1α核转位,下调PFKFB3减少糖酵解,增强血管内皮连接蛋白VE-cad表达,促进肿瘤血管结构功能正常化,改善缺氧微环境,抑制结肠癌生长与肝转移。傲星生物深耕生信分析十余载,有丰富的实验方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




