IF:5.3,多数据库联动+单基因+预后结合实验验证分析GCN1在肝细胞癌中的靶点机制!
题目:高表达的GCN1与肝细胞癌患者的癌症进展和不良预后相关
英文名:Highly expressed GCN1 is associated with cancer progression and poor prognosis in hepatocellular carcinoma patients
杂志:Cancer Cell International
影响因子:5.3
发表时间:2025年3月20日
研究背景:肝细胞癌(HCC)是恶性程度高、死亡率高的常见肿瘤,目前缺乏有效的预后分子标志物和治疗靶点。GCN1作为核糖体结合蛋白,已被证实参与多种癌症的发生发展,但其在HCC中的作用尚未明确。
研究思路:通过TIMER、TCGA、HPA等数据库分析GCN1在HCC中的表达水平及与临床病理特征的关联。生物信息学分析探讨了GCN1表达与免疫浸润、信号通路的关系。通过体外细胞实验(敲低GCN1)研究其对HCC细胞增殖、迁移、侵袭的影响及潜在机制(Wnt信号通路)。
研究结果:
1、GCN1在肝细胞癌中表达上调
利用TIMER数据库研究了GCN1在泛癌症中的表达情况。如图1A所示,GCN1在大多数癌症中的表达水平显著升高,包括膀胱尿路上皮癌、胆管癌、结肠腺癌、食管癌和HCC。对来自HCCDBV2数据库的各种HCC队列的GCN1mRNA水平的分析再次证实了GCN1在HCC中的上调(图1B)。此外,对来自TCGA和Xena数据集的非配对样本(图1C、D)和配对样本(图1E)的分析均表明GCN1在HCC中的mRNA水平升高。从人类蛋白质图谱(HPA)数据库中获得的GCN1免疫组化染色结果显示,HCC中的染色强度更高,进一步证明了GCN1在HCC中的表达上调(图1F)。上述结果表明,GCN1在HCC中表达上调。
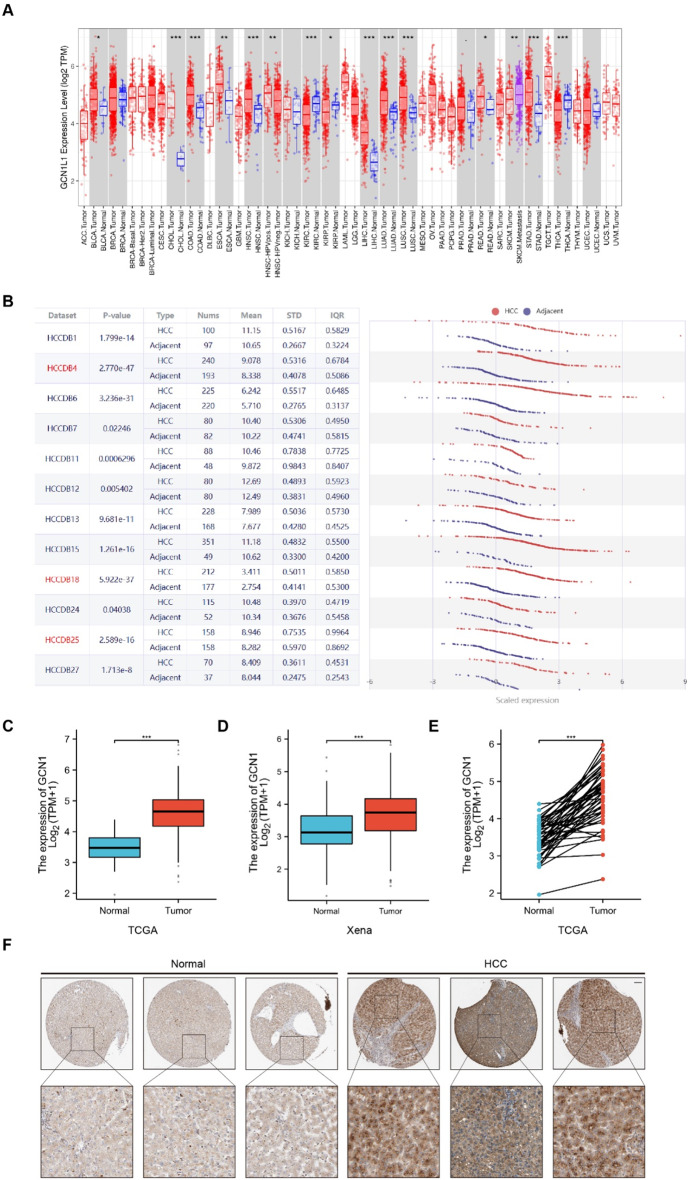
图1
2、GCN1表达与HCC患者临床病理特征的关系
病理T期和N期较高、病理分期较高、组织学分级较高、“有肿瘤”状态、血管侵犯、体重指数≤25、甲胎蛋白水平较高和OS不良的HCC患者的GCN1表达水平也较高(图2A-I)。此外,TCGA-LIHC数据集的逻辑回归分析表明,GCN1表达水平与病理T分期、病理分期、肿瘤状态和组织学分级显著相关。
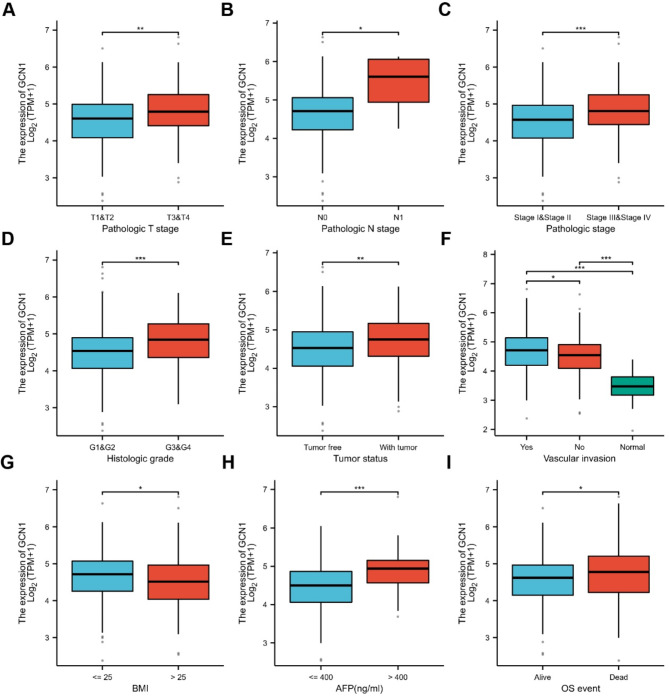
图2
3、GCN1在HCC中表达的预后和诊断价值
采用Kaplan-Meier生存曲线探讨GCN1表达与HCC患者预后的关系。结果显示,GCN1的高表达与HCC患者较短的总生存期(OS)、疾病特异性生存期(DSS)和无进展间期(PFI)相关(图3A-C)。结果显示,在亚裔、体重指数≤25、男性、病理N分期为N0、病理M分期为M0、残留肿瘤为R0和组织学分级为G3≤G4的亚组中,GCN1的高表达与OS差密切相关(图3D-J)。此外,多变量考克斯回归分析还显示,GCN1的高表达与HCC患者的不良预后相关(图3K),这表明GCN1的表达是HCC患者的一个独立的不利预后生物标志物。
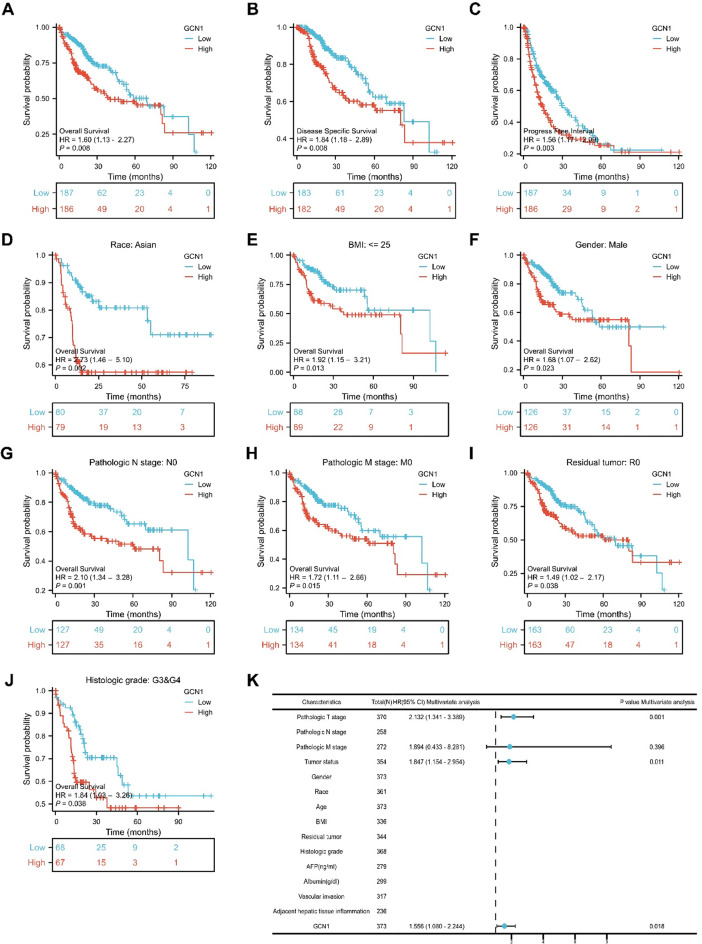
图3
通过接收者操作曲线(ROC)探讨了GCN1在HCC中的诊断价值,结果显示GCN1对HCC具有良好的诊断价值(AUC=0.921)(图4A)。此外,GCN1表达对1年、3年和5年OS的曲线下面积(AUC)分别为0.739、0.644和0.552,表明GCN1对HCC患者的1年和3年生存率具有良好的预测价值(图4B)。此外,还将GCN1表达与一些关键的临床特征相结合,绘制了一个提名图,该图在预测HCC患者的1年、3年和5年生存率方面具有很高的价值(图4C-D)。
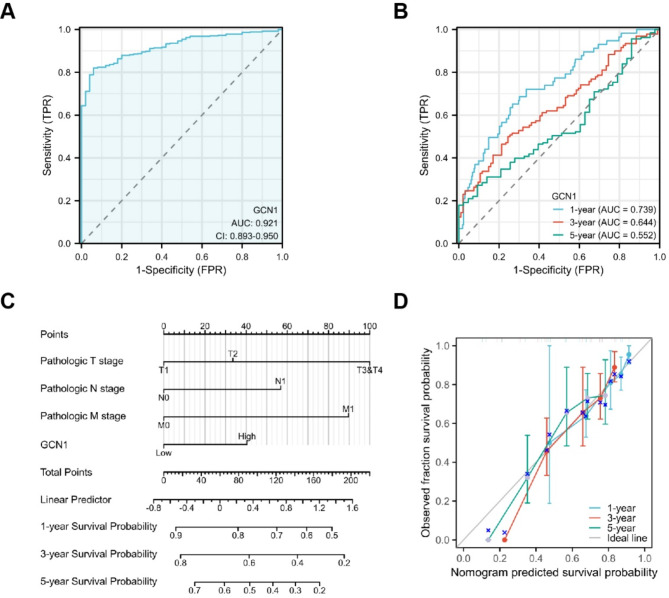
图4
4、GCN1DNA甲基化水平对HCC患者的预后意义
利用MethSurv数据库全面分析了GCN1各甲基化位点的甲基化状态及其与HCC患者预后的相关性。结果显示,GCN1中共有7个CpG甲基化位点(图5a),其中2个被鉴定为预后不利的甲基化位点(cg10801419;cg01199721),2个被鉴定为预后有利的甲基化位点(cg18214436;cg14667104)(图5B-E)。
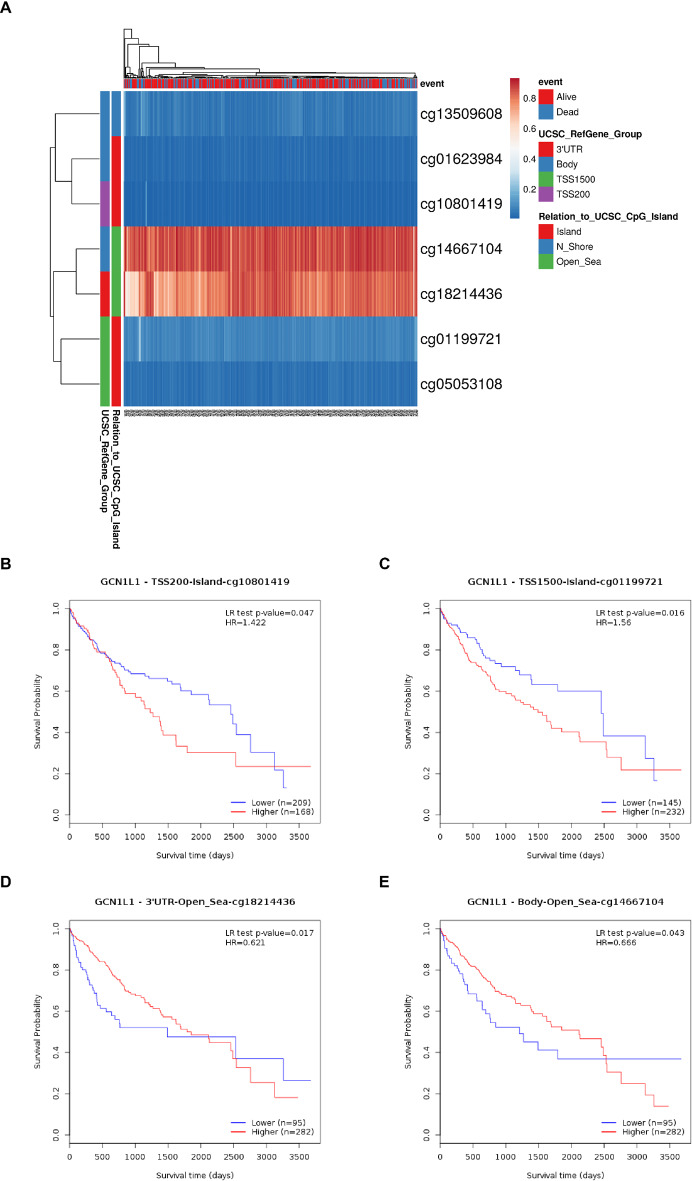
图5
5、HCC中GCN1表达与免疫细胞浸润的相关性
利用斯皮尔曼相关性分析了GCN1表达水平与ssGSEA评分所测量的HCC免疫细胞浸润水平之间的相关性。结果显示,Th2细胞、T辅助细胞、Tcm、Tem和NKCD56bright细胞的浸润水平与GCN1表达呈正相关,而DC细胞、Th17细胞、细胞毒性细胞、pDCs、CD8+T细胞等的浸润水平与GCN1表达呈负相关(图6A)。进一步分析发现,Th2细胞的浸润水平与GCN1的表达呈显著正相关(图6B),而DC细胞的浸润水平与GCN1的表达呈显著负相关(图6C)。结果显示,GCN1高表达组的Th2细胞浸润水平明显高于GCN1低表达组(图6D),而GCN1高表达组的DC细胞浸润水平明显低于GCN1低表达组(图6E)。此外,还评估了24种不同肿瘤浸润免疫细胞亚群比例之间的相关性,并用热图显示(图6F)。上述结果表明,GCN1的过表达与HCC的免疫抑制环境有关。
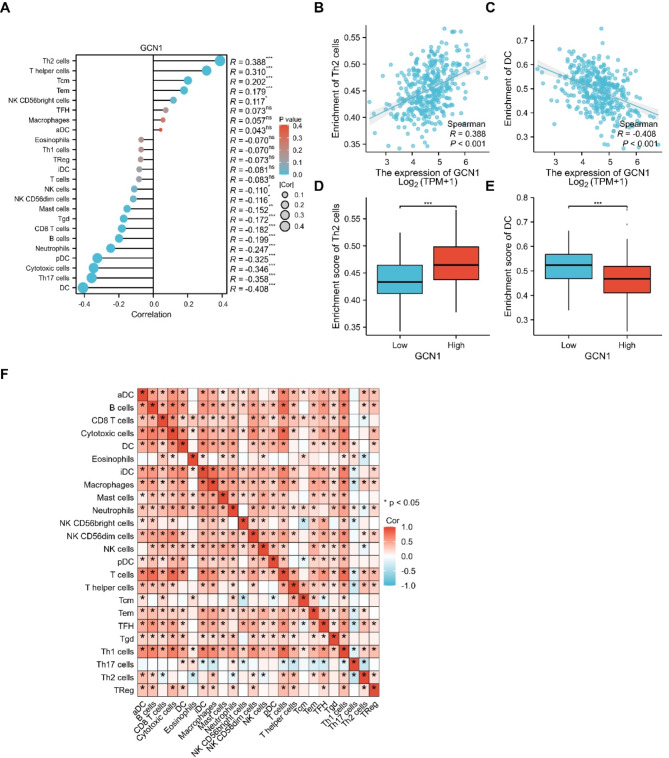
图6
6、GCN1敲低抑制HCC细胞的增殖、迁移和侵袭
为了研究GCN1在HCC中的作用,在GCN1高表达的细胞株Hep3B和SNU398中转染质粒敲除GCN1。Western印迹证实了GCN1在Hep3B和SNU398细胞中的下调(图7A)。CCK-8检测用于评估GCN1对HCC细胞增殖的作用,结果显示GCN1敲除抑制了Hep3B和SNU398细胞的增殖(图7B),EdU检测也证实了这一点(图7C和E)。此外,还进行了Transwell实验来评估GCN1对HCC迁移和侵袭的影响,结果显示GCN1敲除抑制了Hep3B和SNU398的迁移和侵袭能力(图7D和F)。还进行了定量反转录聚合酶链反应(qRT-PCR),以测定与细胞迁移和侵袭相关的几种标记物的mRNA水平。结果表明,敲除GCN1能显著下调MMP2和Vimentin的mRNA水平,同时上调TIMP1和E-cadherin的mRNA水平。
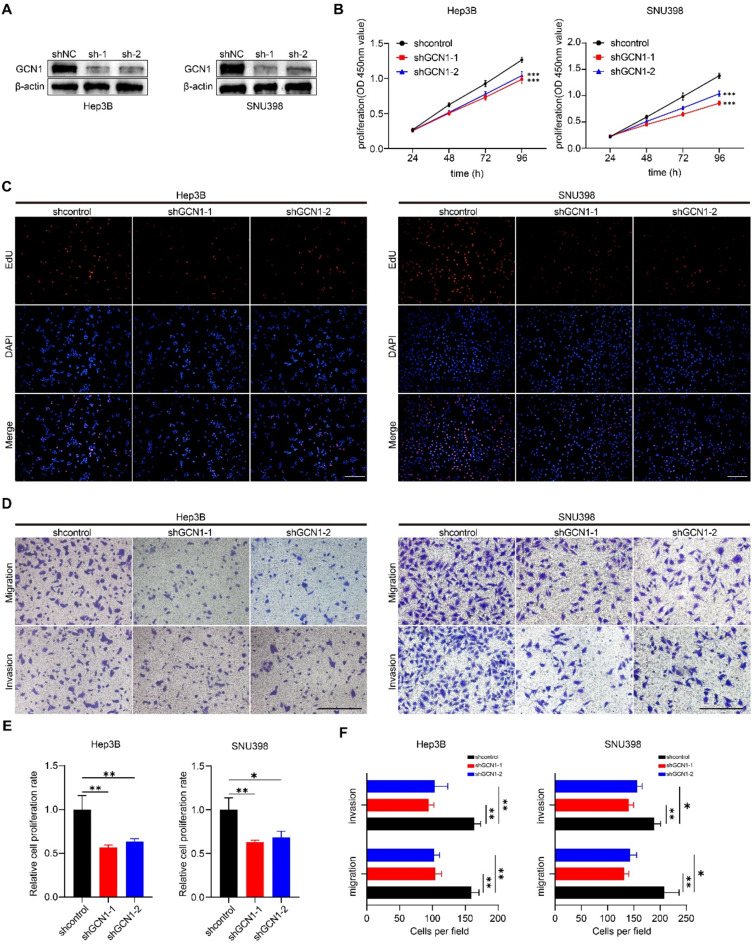
图7
7、GCN1在HCC中的机制
GSEA显示,GCN1影响着与癌症密切相关的通路,如细胞周期、DNA复制、TGF-β信号通路、Wnt信号通路、错配修复和癌症通路(图8A-F)。随后,利用Western blot检测了Hep3B和SNU398细胞中细胞周期蛋白B1(CCNB1)、细胞周期蛋白D1(CCND1)以及Wnt信号通路相关蛋白Wnt3A和β-catenin的蛋白水平。结果表明,敲除GCN1可显著下调CCNB1、CCND1、Wnt3A和β-catenin的表达(图8G),这初步表明敲除GCN1可通过Wnt/β-Catenin通路抑制HCC细胞的增殖、迁移和侵袭。
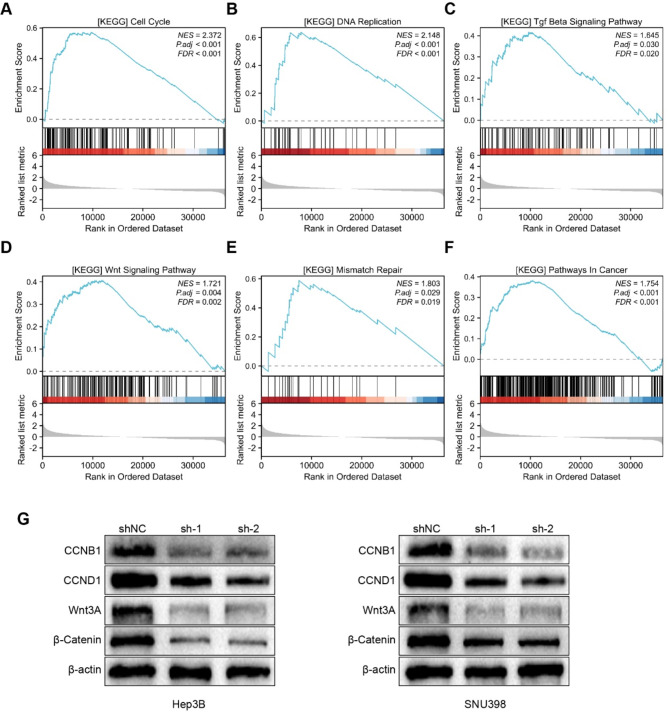
图8
总结:本研究发现GCN1在HCC中高表达,与肿瘤进展、不良预后及免疫抑制微环境相关。敲低GCN1可通过抑制Wnt信号通路抑制HCC细胞恶性行为,提示GCN1可能成为HCC的预后标志物和治疗靶点。




