9分佳绩,生信分析融机器学习,单细胞数据显神威!
题目:单细胞转录组分析揭示转移性肾细胞癌的异质性以及抗血管生成疗法对胰腺转移病灶的影响
英文名:Single-cell RNA-seq reveals heterogeneity in metastatic renal cell carcinoma and effect of anti-angiogenesis therapy in the pancreas metastatic lesion
杂志:Cancer Letters
影响因子:9.1
发表时间:2024年8月
研究背景:透明细胞肾细胞癌(ccRCC)是肾细胞癌(RCC)中最常见的亚型,具有向身体各部位转移的倾向,与其他器官转移相比,肾细胞癌胰腺转移(RCCpm)患者的预后相对更好。通过单细胞转录组数据能解析转移性透明细胞肾细胞癌的异质性肿瘤微环境(TME),揭示TME对治疗反应和临床结果的影响。
研究思路:分析单细胞RNA-seq原发性和转移性病灶数据,以破译不同的转移TME,解码胰腺转移的缺氧和炎性TME。first报道了RCCpm样本的单细胞RNA-seq结果,对RCCpm TME进行了剖析。然后,结合其他原发性RCC和RCC骨转移(RCCbm)样本,对mRCC TME进行了图谱分析,揭示了各细胞组分的异质性功能及其内在特征。然后,基于机器学习的生成模型与TCGA数据库和实验细胞系敏感性数据一起用于预测RCCpm样本的药物反应。同时还验证了舒尼替尼等抗血管生成治疗的效果。
研究结果:
1、原发性和转移性RCC样本分析:TME成分和功能的变化
为了研究RCC患者体内TME的异质性,选用手术切除后无转移的原发性RCC样本(n=3)、有多处转移的原发性RCC样本(n=3)、原发性骨转移样本(RCCbm,n=3)、肾脏细胞癌胰腺转移(RCCpm,n=3)。并对其中一个样本送公司进行单细胞转录组测序,对所有RCC样本进行整合、去批次效应分析(图1A)。得到60983个细胞和25280个基因被用于下游分析。随后进行了细胞注释鉴定(图1B和C),基于表达模式,大致确定了8种细胞类型(B细胞、内皮细胞、上皮细胞、成纤维细胞、肥大细胞、骨髓细胞、中性粒细胞、T细胞)(图1C)。T细胞和髓系细胞的比例很高,上皮细胞和B细胞很少被捕获,这表明肿瘤内的免疫环境非常活跃。
此外,在UMAP还原中对样本进行了单独分析,结果显示出相当大的异质性(图1D和E)。同时,RCCbm样本中的细胞比其他部位的样本少(图1E)。随后计算了每种细胞类型中转移样本和原发性RCC样本的不同表达基因(DEGs)(图1F)。研究发现,一些功能基因如CD8A、S100A8/9在转移样本中上调。同时,还发现了几种细胞类型的功能转换,例如,成纤维细胞中MMP13和CXCL12的上调与转移性TME中细胞外基质建模和炎症信号转导有关。

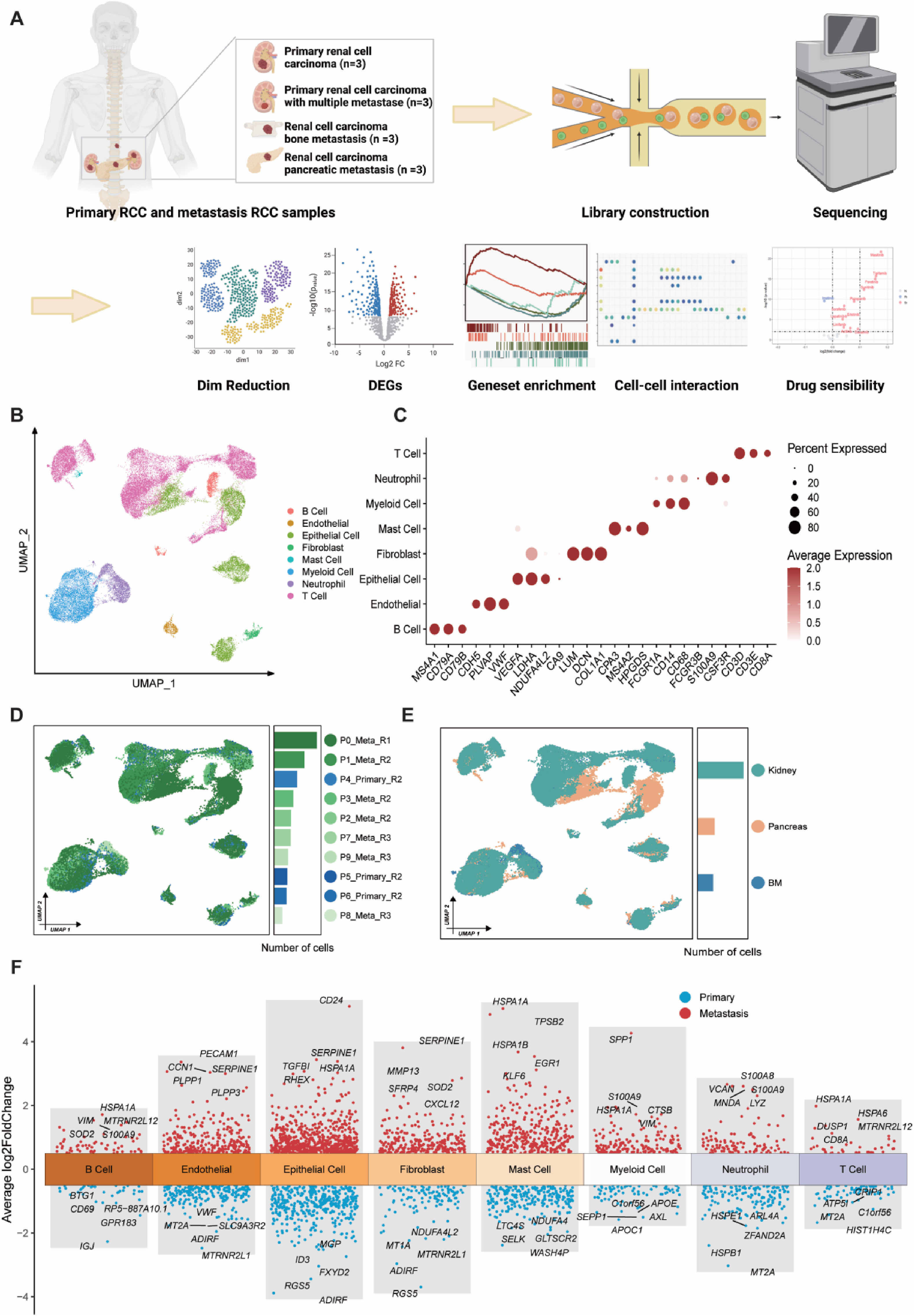
图1
2、RCCpm TME经历了新陈代谢重编程,并改变了生物合成
为了分析RCCpm TME的细胞成分,将10890个细胞,基于标记基因进行注释(图2A和B)。在RCCpm样本中未发现胰腺星状细胞和内分泌细胞,这表明RCCpm TME与胰腺导管腺癌等常见胰腺癌相比具有很大的异质性。同时,计算每种细胞类型的比例,也与胰腺癌明显不同,上皮细胞(7415个,68.09%)最多,其次是T细胞(1192个,68.09%)。但很少发现成纤维细胞(TME的10890个细胞中有476个成纤维细胞,占4.37%)(图2A)。通过IHC染色证实了RCCpm,与配对的正常胰腺组织相比,巨噬细胞在RCCpmTME中富集,以SMA标记的成纤维细胞较少且杂乱无章(图2C)。
作者进一步研究了RCCpm TME中细胞的核型。几乎所有的非整倍体细胞都出现在上皮细胞中,这些细胞被认为是高度恶性细胞,而其他二倍体上皮细胞则被定义为低恶性潜能细胞或正在发生癌变的上皮细胞(图2D)。计算了非整倍体上皮细胞与其他上皮细胞的不同表达基因(DEGs)。随后,DEGs的基因功能富集结果显示,其变化主要集中在能量代谢(ATP代谢过程、有氧呼吸等)、蛋白质合成(细胞质翻译、蛋白质定位到内质网和核糖体等)和细胞粘附(病灶粘附、细胞-基质连接和粘附素结合等)方面(图2E)。所有这些功能变化都与肿瘤的进展密切相关,表明RCCpm TME具有活跃的侵袭性。
总之,与原发性RCC、RCCbm和原发性胰腺癌相比,RCCpm TME表现出与氧相关的代谢重编程、细胞粘附性改变和蛋白质合成活跃等明显特征。
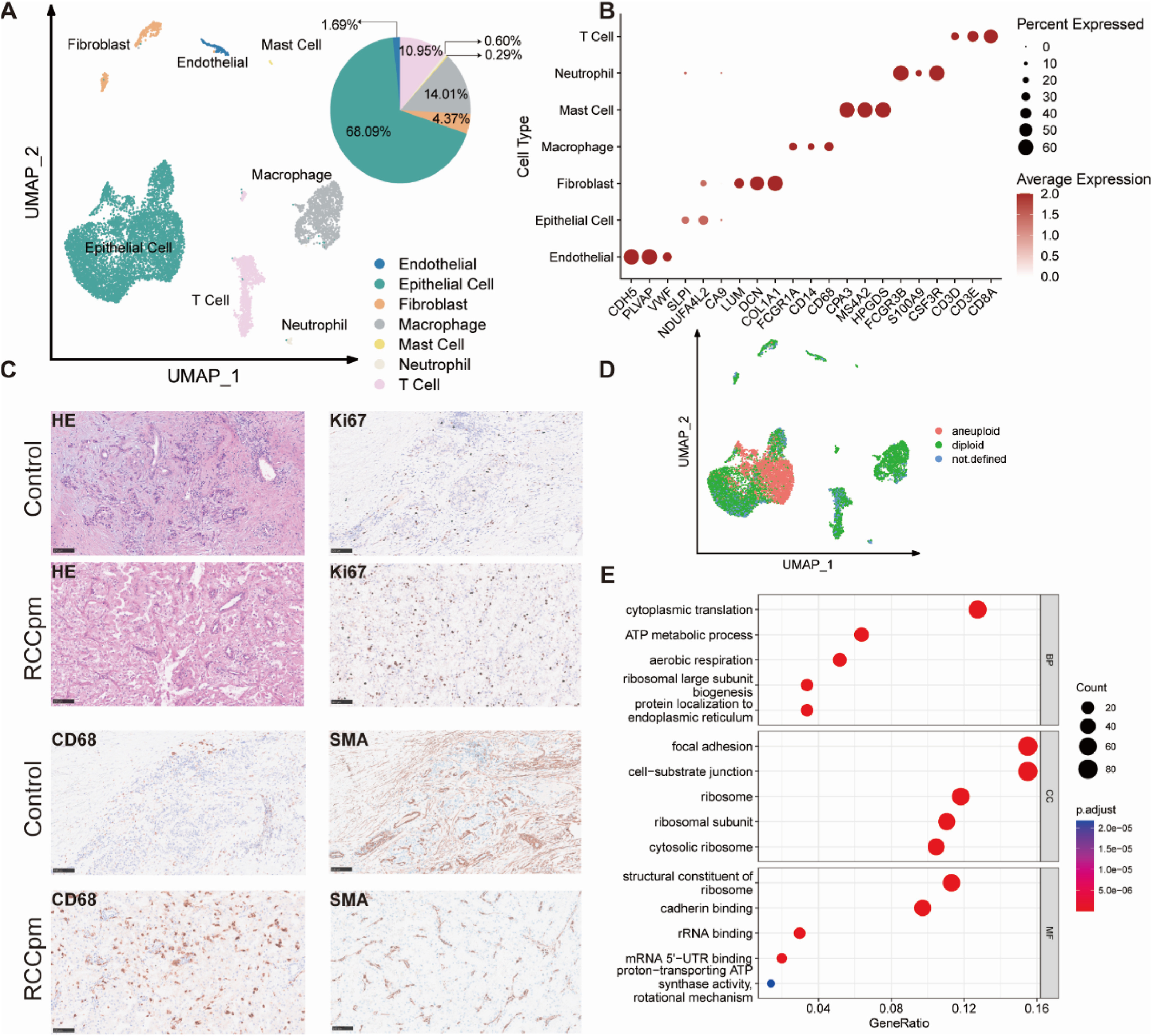

图2
3、PAX8-myc信号在上皮细胞中上调,导致缺氧和炎症性TME
对所有上皮细胞集群进行了分组和重新分析,发现了四个不同的集群(图3A)。作为RCC的标记基因,NDUFA4L2被证实在肿瘤细胞中广泛表达,而上皮细胞几乎没有表达CFTR,CFTR是原发性胰腺癌细胞和胰腺上皮细胞的标记基因。因此,进一步确定了RCCpm病变既不同于胰腺组织,也不同于原发性胰腺癌(图3B)。此外,当检索上皮细胞的拷贝数分析时,发现NDUFA4L2的表达与核型和基因组的稳定性相关(图3C)。非整倍体细胞中NDUFA4L2的表达明显高于二倍体细胞,这证实了非整倍体细胞的高度恶性。同时,为了在组织学水平上确认RCCpm,对RCCpm组织进行了CA9、CD10和CK7染色(图3D)。CA9和CD10在大多数ccRCC细胞中都有表达,而CK7在ccRCC中则呈显性阴性。
作者将第1组上皮细胞作为参照,因为它们的核细胞相对稳定,肿瘤基因表达量较低。计算了与其他上皮细胞相比的DEGs,并根据肿瘤特征进行了基因组富集分析(GSEA)。在上皮细胞群1中,通过NF-κB和P53通路的TNFα信号转导上调,而氧化磷酸化、myc靶点和活性氧(ROS)通路则反向下调(图3E)。这些通路表明,上皮簇1可能是肿瘤前期细胞的中转站,但不会发展为恶性细胞。与上皮细胞簇1相比,GSEA分析还分别应用于其他三个上皮细胞簇,结果一致显示myc靶点和氧化磷酸化通路显著上调(图3E)。
同时,还引入了RNA速度矩阵来区分核细胞依赖的发育方式。RNA速度被可视化并按核细胞分组(图3I)。上皮簇2有形成簇的趋势,分析了每个上皮簇中的DEGs,并观察了从上皮簇1到上皮簇的进展趋势(图3F)。有研究证实,myc信号在肾癌中通过关键介质PAX8与CCND1、HNF1B和HIF2A相互影响和调控。因此,检测了这些MYC信号相关基因的表达,证实这些基因在恶性细胞簇中上调(图3G)。此外,对两个先前诊断的RCCpm样本(共三个样本)进行了IHC检测。结果显示,与正常胰腺相比,PAX8在RCCpm样本中上调(图3H)。这间接证实了PAX8-MYC通路在RCCpm中起着至关重要的作用。
总之,通过上皮细胞的表达模式和生物学功能,确定了四个不同的上皮细胞群。在恶性细胞中,Myc通路和氧化磷酸化通路得到强调,代谢重编程被解读为缺氧和炎症环境以及激活的糖酵解和脂肪酸代谢。

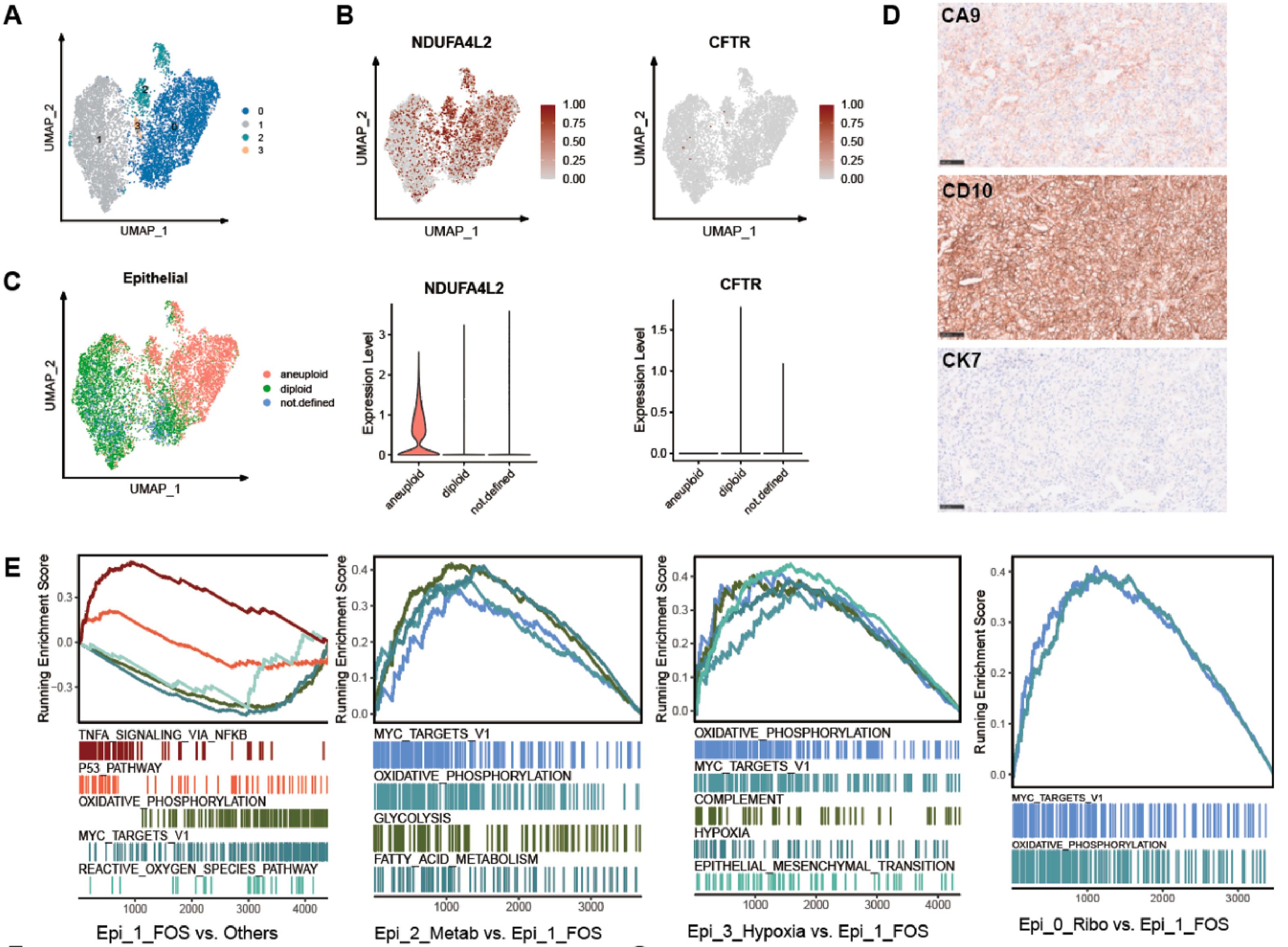
图3
4、RCCpm TME表现出活跃的免疫反应,内皮细胞是核心细胞
RCCpm TME中的细胞类型也不尽相同,因此,研究了其他细胞成分的重塑及其对肿瘤进展的影响。并根据其表达模式确定了免疫细胞的六种细胞类型(图4A和B)。结果发现,巨噬细胞等髓系细胞表达了大量细胞因子,如IL1B、CXCL2和CXCL12,它们不仅激活了先天性免疫,还诱导了T细胞的活化。同时,大多数T细胞为幼稚T细胞,CD8+T细胞表达颗粒酶(GZMK),表现出活跃的细胞毒性杀伤功能,但胰腺癌中浸润的大多数T细胞已衰竭。此外,几乎没有检测到B细胞,这可能是由于个体差异或测序偏差造成的。
细胞-细胞互作分析发现Epi0Ribo、成纤维细胞、巨噬细胞和内皮细胞在TME中比其他集群更活跃(图4C)。发现内皮细胞的传入信号模式包括VEGF、PECAM1、SELL、CDH5和GDF,传出信号包括APP、PECAM1、CDH5和PDGF(图4D-E)。
总之,RCCpm TME显示出活跃的免疫反应,而内皮细胞是与大噬菌体和CD8+T细胞积极交流的核心角色。
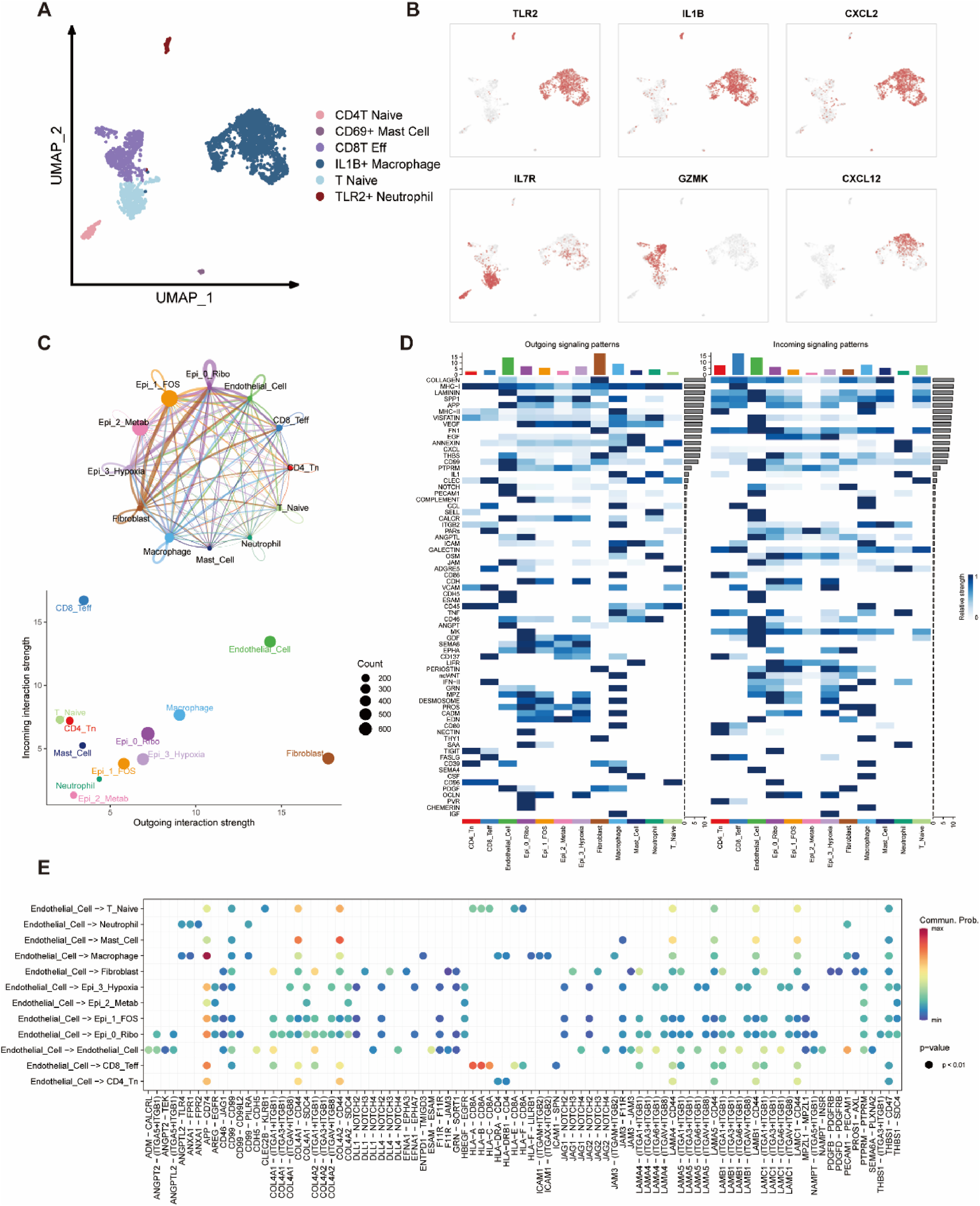
图4
5、舒尼替尼被证实是治疗RCCpm的有效方法
TKIs是RCC和mRCC的一线治疗方案之一。对于mRCC,TKIs的疗效可能并不亚于细胞切除肾切除术。内皮细胞在RCCpm TME中发挥着关键作用,接下来分析了RCCpm样品的潜在药敏性。由于单细胞RCCpm数据和大约五百个TCGA样本之间的样本数量存在偏差,使用了基于机器学习的生成模型来生成具有相似表达模式的RCCpm批量RNA-seq数据。首先对RCCpm样本和TCGA样本中的上皮细胞进行了子集,并对药物敏感性进行了预测。发现大多数一线治疗药物被认为是耐药的。然后,作者将所有单细胞数据作为机器学习模型的输入,并生成了可以剖析整个RCCpm TME的新样本。结果显示,大多数酪氨酸激酶抑制剂对RCCpm样本都有效,包括上述指南推荐作为可选一线靶向疗法的舒尼替尼在内(图5)。所有这些结果都证明了内皮细胞在RCCpm TME中的关键作用,并证实了作者的假设,即异质性转移性RCC TME会导致不同的生物学特征和治疗反应。
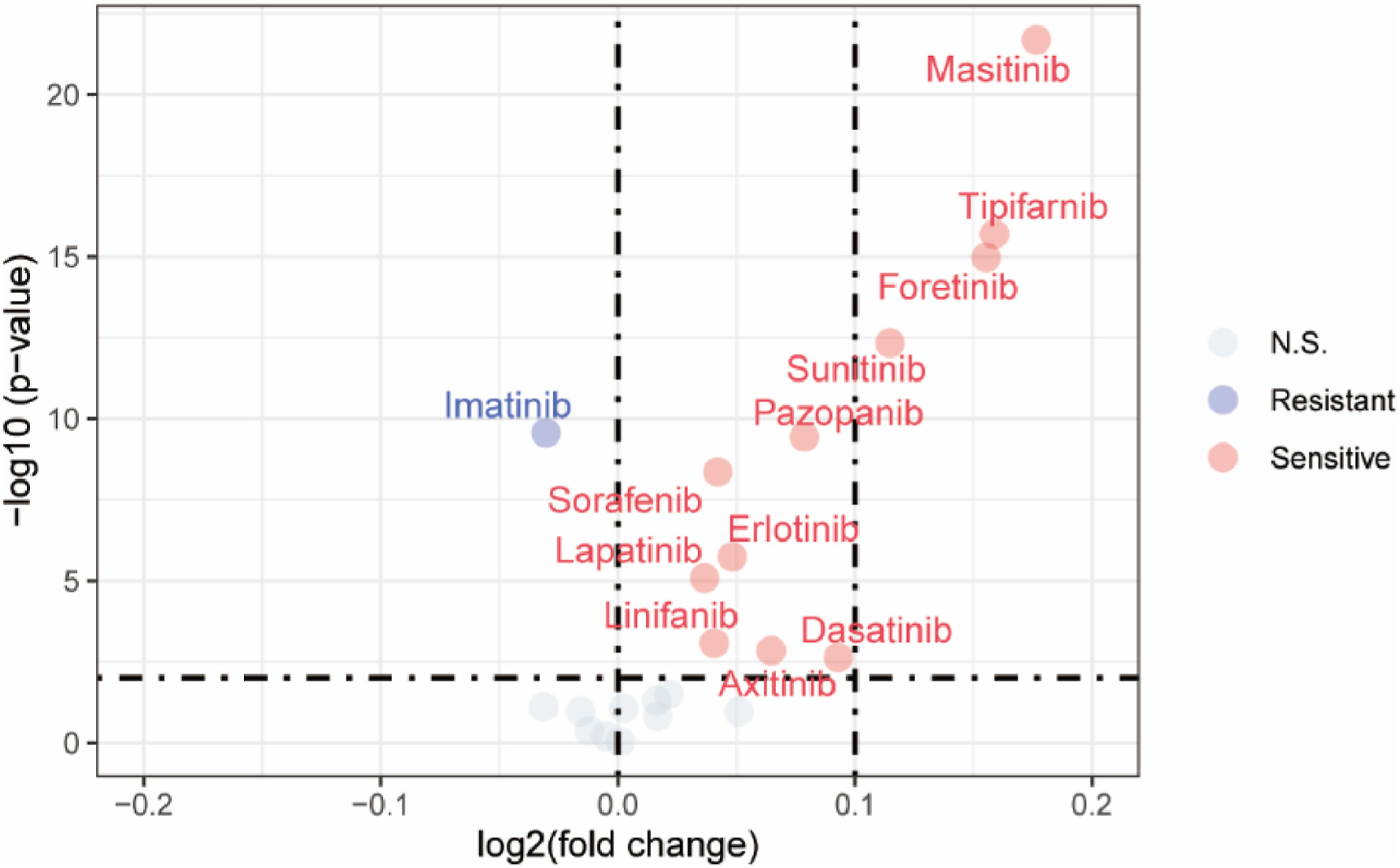

图5
总结:9分+生信分析,辅以详尽的剖析与阐述,整个过程虽不复杂,却展现出极高的逻辑性,值得深入学习与借鉴!傲星生物提供多种高阶生信分析方案,另有完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!





