网络药理学+分子对接+实验验证,揭示了罗汉松树脂素在前列腺癌中的抗转移潜力
题目:新型系统生物学实验流水线揭示了罗汉松树脂素在前列腺癌中的抗转移潜力:网络药理学、生物信息学和实验验证的综合方法
英文名:Novel systems biology experimental pipeline reveals matairesinol’s antimetastatic potential in prostate cancer: an integrated approach of network pharmacology, bioinformatics, and experimental validation
杂志:Briefings in Bioinformatics
影响因子:Q1/6.8
发表时间:2024年9月5号
研究背景:罗汉松树脂素(MAT)是一种植物木质素,因其在乳腺癌和前列腺癌等激素敏感性癌症中的抗癌特性而闻名,在治疗转移性前列腺癌(mPC)方面提供了一条有前景但未被充分开发的途径。
研究思路:为了阐明其特定的治疗靶点和机制,采用网络药理学(NP)、生物信息学、基于基因MANIA的功能关联(GMFA)和实验验证融为一体研究方法。通过挖掘在线数据库,发现了27个mPC和MAT的共同靶点,通过STRING构建了MAT-mPC蛋白-蛋白相互作用网络,并利用CytoHuba确定了11个中心靶点,如EGFR、AKT1、ERBB2、MET、IGF1、CASP3、HSP90AA1、HIF1A、MMP2、HGF和MMP9。利用DAVID,GO分析强调了转移相关过程,如上皮-间质转化、细胞迁移的正调控,以及关键的KEGG通路分析,包括癌症、前列腺癌、PI3K-Akt和MAPK信号转导,而UALCAN和GEPIA2等数据库鉴定了前11个中心靶点在mPC患者生存分析和基因表达模式中的临床意义。运用一种新的富集方法(GMFA)进一步丰富了网络药理学研究结果。分子对接分析表明了MAT与11个中心靶点之间的实质性相互作用。模拟研究证实了MAT与选定靶点的稳定相互作用。利用RT-qPCR和各种基于细胞的检测方法在PC3细胞中进行的实验验证证实了MAT对mPC的抗转移作用。总的来说,进行了详尽的NP分析,辅以GMFA、分子对接、分子动力学模拟和实验验证,强调了MAT在通过不同治疗途径靶向mPC方面的多方面作用。
研究结果:
1、构建PPI网络并分析MAT针对mPC的前11个枢纽目标
采用了一种系统方法来预测针对mPC的MAT靶点。首先,从Swiss Target Prediction、Pharmapper和Superpred数据库中检索了MAT靶点,得出了524个潜在靶点。同时,还从GeneCards和DisGeNet数据库中确定了mPC靶点,得出了236个靶点。交叉分析发现了MAT针对mPC的27个潜在治疗靶点(PTM-mPC)(图1A)。PPI网络包括27个从mPC和MAT基因交叉点识别出的PTM-mPC中心靶标(图1B)。该网络有27个节点,163条边,平均PPI富集P值小于1.0e-16,平均局部聚类系数为0.75,平均节点度为12.1。通过CytoHubba插件,Cytoscape分析进一步确定了前11个基因--EGFR、AKT1、ERBB2、MET、IGF1、CASP3、HSP90AA1、HIF1A、MMP2、HGF和MMP9(图1C),这些基因按其程度算法得分排序,用颜色表示节点程度。
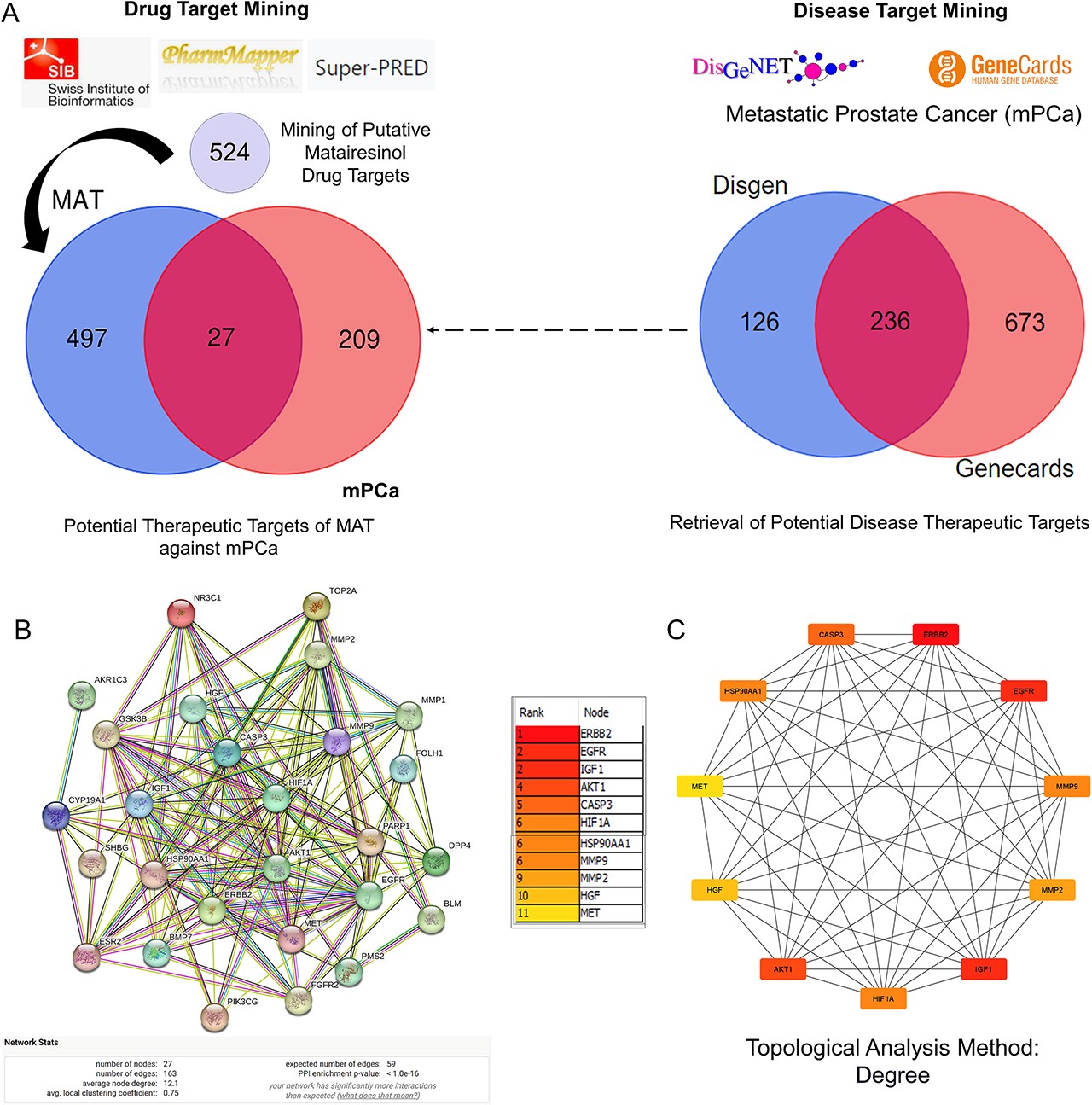
图1
2、通路的富集分析和MAT靶向mPC的预测靶标的C-T-P网络构建
利用DAVID分析了KEGG通路中的27条共同路径,以了解MAT诱导的mPC进展改变。发现了36条通路(FDR≤0.05,P值≤0.05),前20条通路见图2A。构建了一个“化合物-靶点-通路(C-T-P)”网络(图2B),以直观显示MAT、其目标和相关通路。值得注意的通路包括:癌症中的通路、癌症中的原茶聚糖、PI3K-Akt信号通路、MAPK信号通路、前列腺癌和表皮生长因子受体酪氨酸激酶抑制剂抗性。前列腺癌与8个基因密切相关,包括GSK3B、HSP90AA1、ERBB2、AKT1、IGF1、MMP9、表皮生长因子受体、和表皮生长因子受体2在C-T-P网络中的作用,突显了MAT与癌症相关信号级联之间的潜在联系。利用DAVID进行的GO富集分析发现,150个BP、20个CC和35个MF术语的P值达到了≤0.05阈值。应用FDR过滤器(FDR≤0.05)得到34个BP项、3个CC项和16个MF项。图2C显示了前15个BP和MF术语以及3个CC术语。BP富集包括转录调控、信号转导、细胞凋亡、细胞增殖和上皮-间质转化等通路。CC术语表明基因存在于细胞膜和细胞外空间等细胞区域。MF分析显示了一些关键功能,如如蛋白质结合、ATP结合和激酶活性。这项分析加深了人们对MAT对mPC治疗作用的了解。
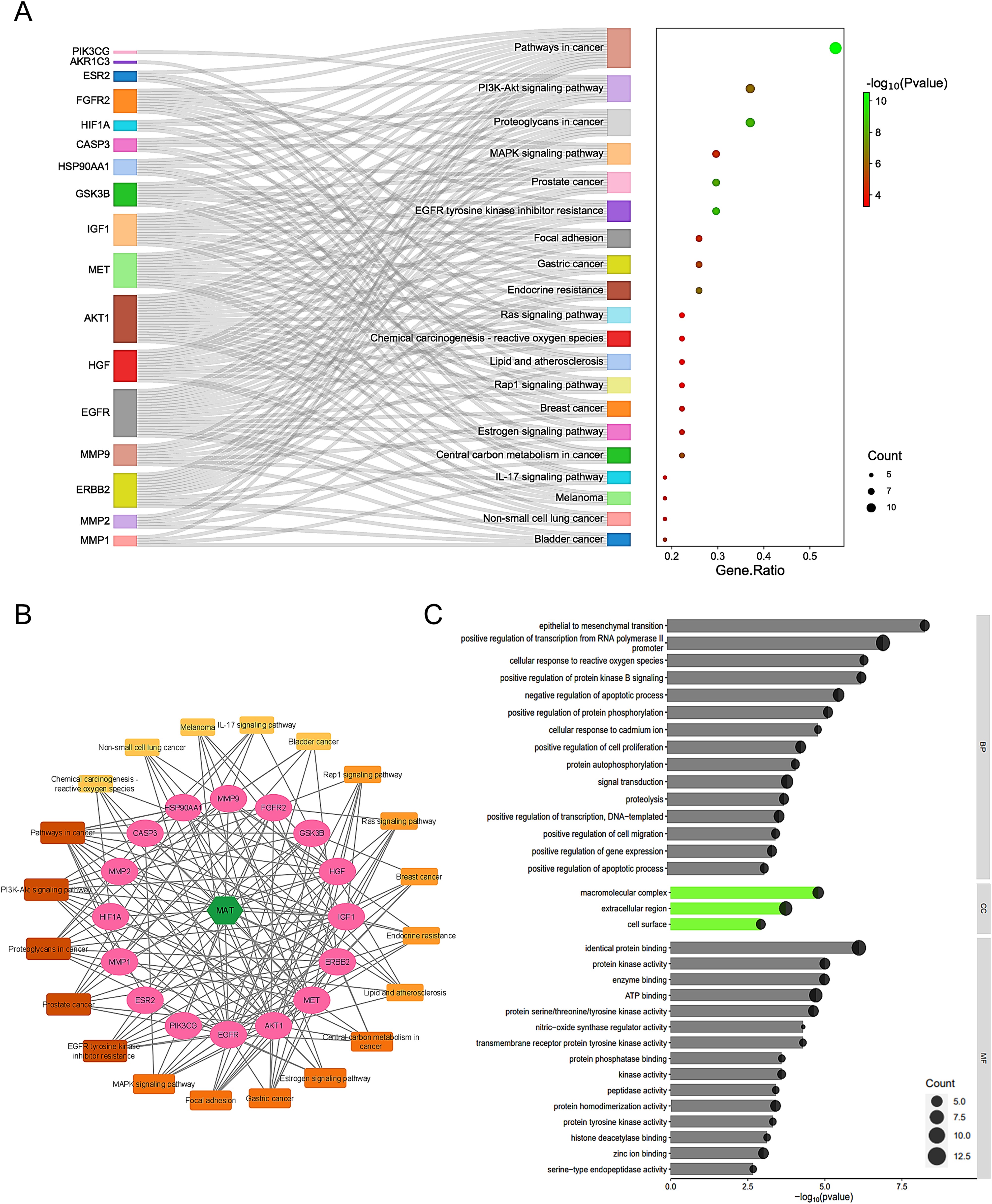

图2
3、基因表达模式比较分析,重点关注MAT在正常组织和肿瘤组织中针对mPC的前11个枢纽靶点
利用UALCAN等公开数据集对前列腺腺癌患者的前11个枢纽靶点进行了基因表达分析。与正常组织相比,MMP-9、AKT1和CASP3在原发性肿瘤、高Gleason评分(6-10分)和转移性结节中的表达明显增加。此外,随着格里森评分的升高,AKT1、ERBB2、HSP90AA1和MMP9的表达也呈上升趋势,尽管AKT1和ERBB2在格里森评分为10时的表达有所下降(图3)。这些发现揭示了枢纽靶点在不同前列腺腺癌进展阶段的不同表达模式。
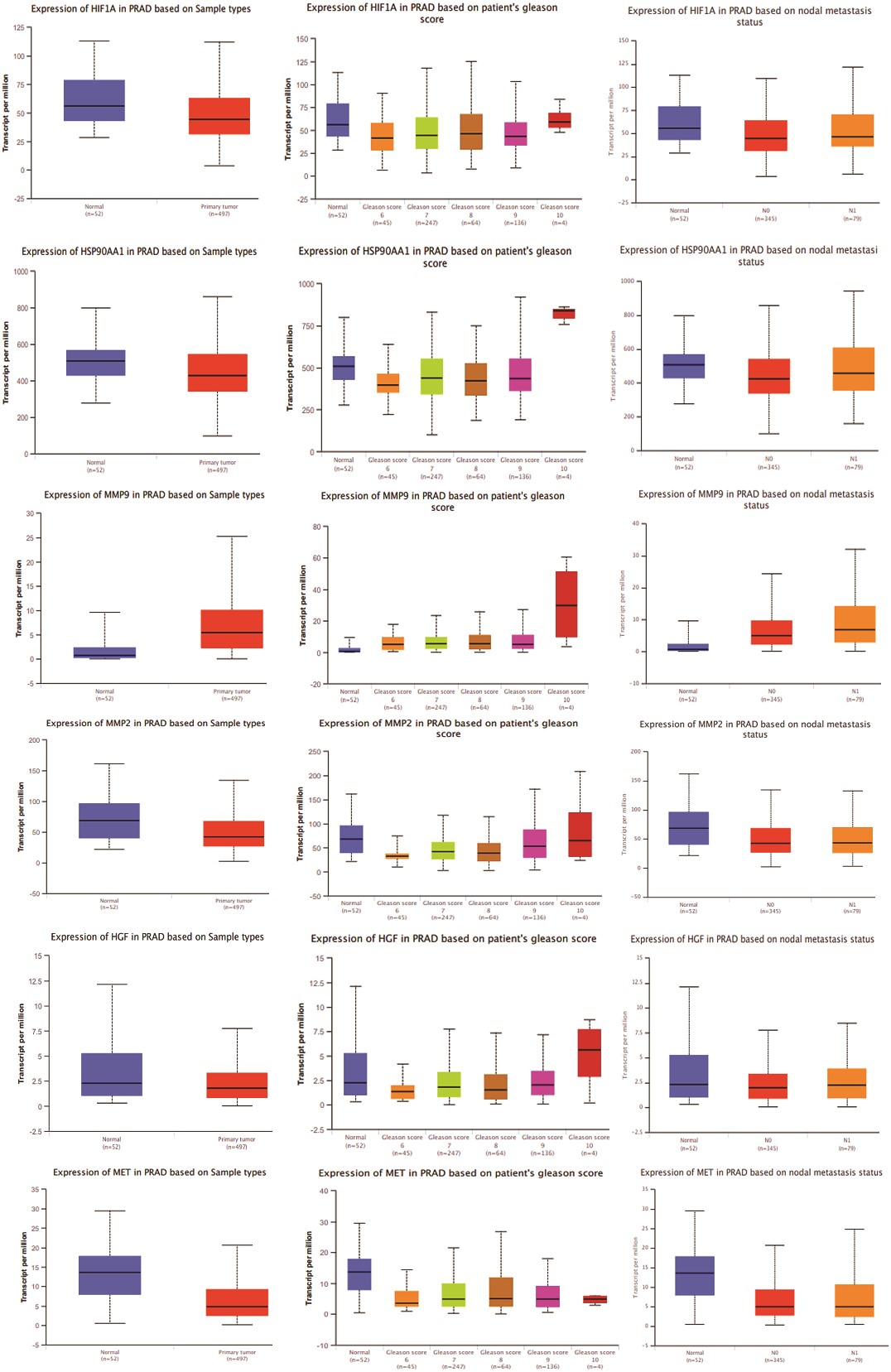

图3
4、前列腺腺癌前11个枢纽基因的存活率分析:对患者预后和治疗策略的影响
生存图分析评估基因表达模式和患者生存结果,这对预后和治疗策略至关重要。利用GEPIA2分析了前11个枢纽靶点的OS和无复发生存(RFS)概率(图4)。生成中位数截断值为50%且风险比为95%置信区间的图。值得注意的是,在RFS分析中,HSP90AA1、MMP2、AKT1、CASP3和ERBB2的生存率随着时间的延长而降低。相反,随着前列腺癌的进展,HIF1A、HSP90AA1、AKT1、MMP9和ERBB2表达的升高会显著降低总生存率。这些研究结果表明,中枢基因表达水平对前列腺癌患者的生存结果有重大影响。


图4
5、MAT针对mPC的前11个枢纽靶标的分子对接和分子动力学模拟研究
通过分子对接,探索了MAT与前11个mPC靶点的相互作用,以了解它们的结合亲和力和治疗意义。观察到MAT与ERBB2(-8.6)、AKT1(-8.5)、MMP-9(-8.4)、MET(-7.8)和表皮生长因子受体(EGFR)(-7.6)的结合能值较低,表明其具有较强的亲和力。值得注意的是,MAT与酪氨酸激酶膜受体ERBB2、表皮生长因子受体EGFR和MET有很高的亲和力,这表明它可能会抑制酪氨酸激酶的活性。此外,MAT与HSP90AA1和MMP-2的结合能分别为-7.1和-5.5 kcal/mol(图5)。由于没有合适的PDBID用于抑制位点的共晶体结合,作者进行了与IGF1R和MET(IGF1和HGF生长因子的受体)的对接分析。此外,还进行了MAT与CASP3的抑制剂XIAP的对接,以研究MAT对CASP3激活的可能调节作用,考虑到缺乏支持CASP3激活位点的合适PDBID,对接结合能(-6.1)。

图5
根据它们在 mPC 中的结合亲和力和生物学相关性,前5个枢纽靶标ERBB2、AKT1、MMP9、MET和EGFR进行MD模拟(图6)。RMSD分析表明,与ERBB2-CL复合物(平均RMSD:0.5nm)相比,ERBB2-MAT复合物(平均RMSD:0.3nm)具有更好的稳定性。RMSF分析表明,MAT结合的ERBB2波动较小。ERBB2-MAT复合物的Rg保持稳定~2nm。AKT1-MAT。在50ns之前,RMSD比较稳定,但之后就出现了偏差。RMSF在AKT1-MAT的N端结构域波动较大。AKT1-MAT的Rg稳定在2.2nm。MMP9复合物显示出相似的RMSDRMSF,Rg稳定在1.525nm。与MET-CL相比,MET-MAT的RMSD稍低,RMSF和稳定Rg相似。表皮生长因子受体复合物的RMSD和RMSF较高,稳定的Rg~2.2nm。CL与表皮生长因子受体形成了三个稳定的氢键,而MAT则偶尔形成氢键。

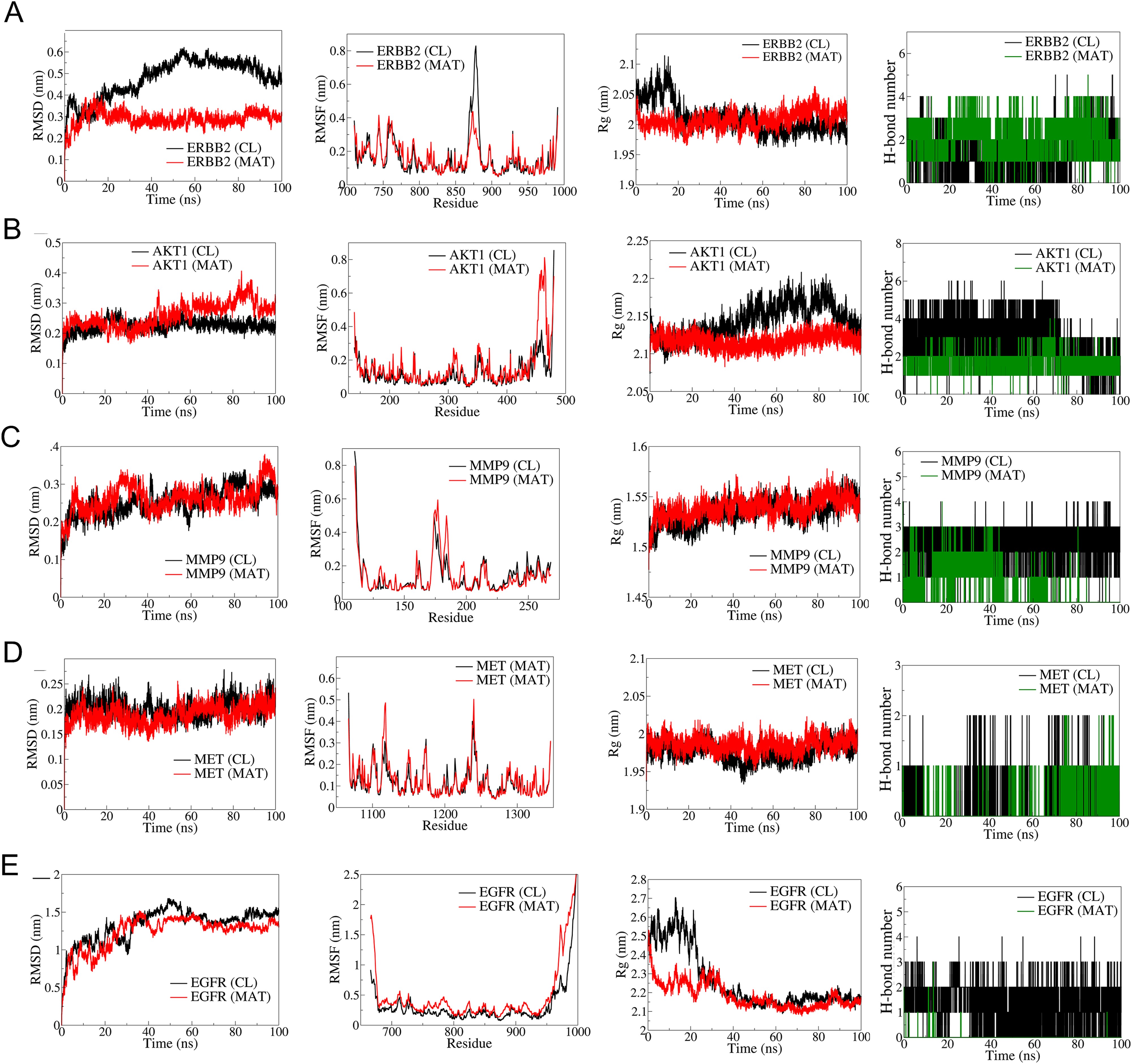
图6
6、基于GeneMANIA的MAT针对mPC的前11个枢纽靶标的功能关联网络分析
作者利用他们之前建立的GeneMANIA分析方法,扩展了前11个中心目标基因列表,确定了每个中心靶点增加10个基因(图7),从而形成GMFA扩展数据(GMFA-ED)。去除重复基因后,该数据集由112个基因组成,有助于进行全面的基因-基因相互作用分析。GMFA方法整合了共表达、遗传相互作用和物理相互作用参数,以捕捉与疾病过程相关的各种基因。GMFA-ED在随后的GO和KEGG富集分析中发挥了重要作用,为探索与已识别基因相关的功能意义奠定了坚实的基础。
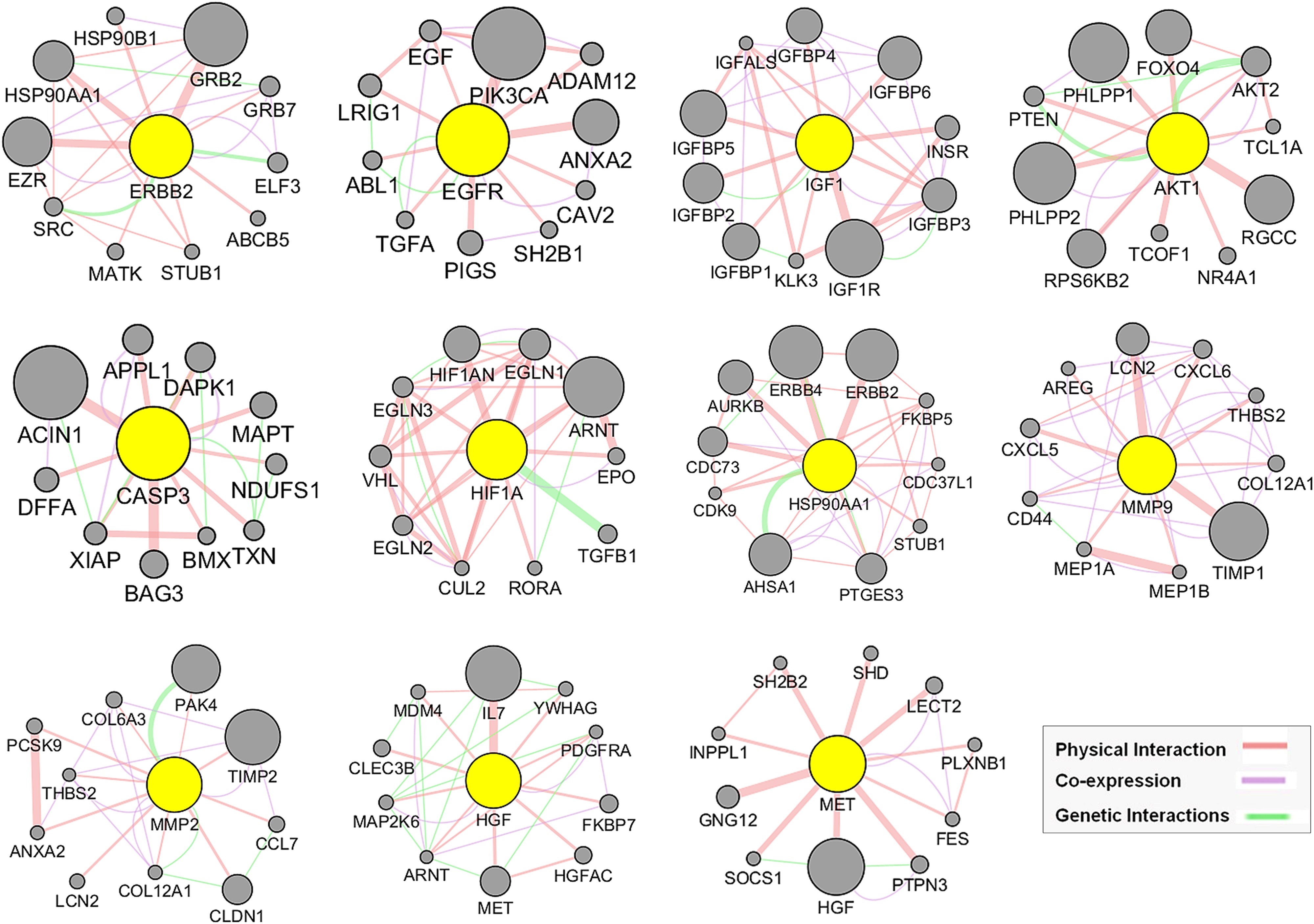
图7
7、GO和KEGG富集分析、C-T-P网络构建以及与MAT和mPC相关的GMFA-ED富集比较分析
GMFA-ED数据集揭示了一个扩展的基因网络,其中包括112个基因,形成了一个功能基因网络(FGN)(图8A)。使用DAVID对基因本体论和通路进行了分析。数据库揭示了BP的显著富集,包括对mPC进展至关重要的通路,如蛋白激酶B信号转导、表皮生长因子受体信号转导、ERK1和ERK2级联调控以及细胞迁移。此外,与质膜相关的富集CC基底外侧质膜和基底质膜等蛋白,强调了它们在癌症转移中的相关性。经GMFA-ED分析后富集的中频蛋白表明,它们与生长因子受体相关的信号转导密切相关,包括蛋白激酶活性、跨膜受体蛋白酪氨酸、生长因子受体信号转导和生长因子受体信号转导。激酶活性、蛋白磷酸酶结合、蛋白酪氨酸激酶活性、胰岛素受体底物结合、胰岛素样生长因子结合和胰岛素样生长因子结合(图8B)。基因组学分析后的KEGG通路分析显示了mPC相关信号的丰富性,突出了癌症中的HIF1A、ErbB、FOXO和微阵列等通路。PI3K/Akt信号显示了广泛的富集,强调了关键的参与者与GMFA-ED分析前相比AT-Targets-Pathways网络显示了显著的相互作用(图8C)。利用来自GMFA-ED的前20个信号通路构建的MAT-靶标-通路网络揭示了显著的相互作用(图8C)。该网络有82个节点(MAT、61个靶标和20个通路)和392条边、表明MAT通过关键信号通路中的各种靶点明显参与(图8D),包括癌症中的通路、PI3K/Akt通路、癌症中的蛋白聚糖、MAPK信号通路,这些发现强调了这些通路在介导MAT对mPC的抗转移治疗效果方面的共同作用。
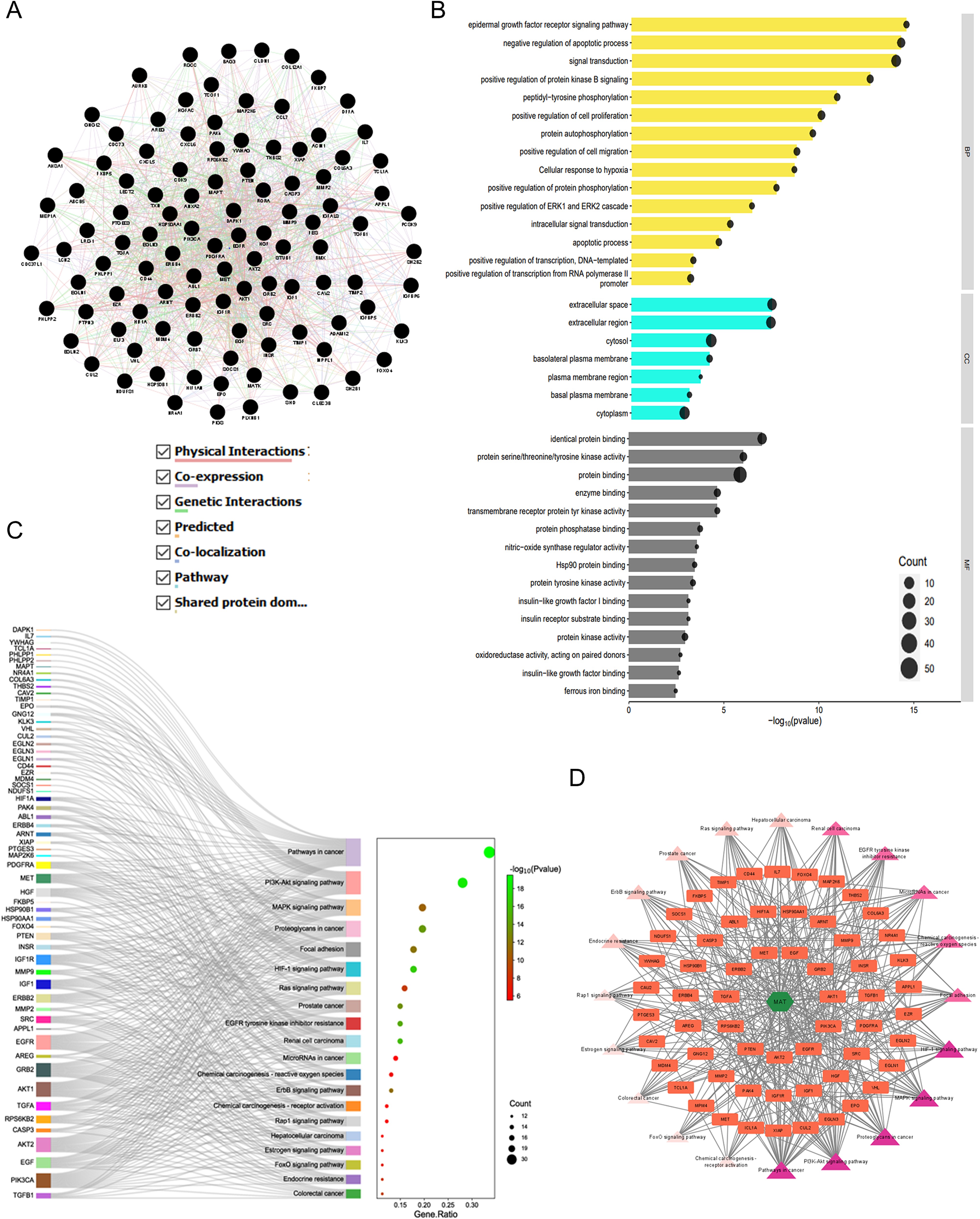
图8
图9展示了GMFA实施前后GO和KEGG富集分析的直观对比(PTM-mPC与GMFA-ED)。GMFA-ED的GO和KEGG富集分析揭示了与MAT对抗mPC的潜在靶点相关的BP、CC和MF的全面富集情况。与最初的枢纽靶标(PTM-mPC)富集相比,这些富集更为相关,有助于深入了解MAT在mPC中潜在抗转移作用的复杂分子机制。在前列腺癌方面,GMFA-ED富集后的KEGG通路分析确定了PI3K-Akt信号通路中基因的大量富集。值得注意的是,这种富集包括六个基因:GF、GFR、PI3K、Grb2、PTEN和Akt。需要强调的是在对PTM-mPC的初步分析中,除了GF、GFR和Akt外,没有观察到MAT的富集作用,而GF、GFR和Akt先前已被确定为MAT的靶点。这强调了通过GMFA-ED分析在揭示PI3K-Akt信号通路参与MAT对前列腺癌的潜在抗转移作用方面所获得的更强、更具体的见解(图10)。
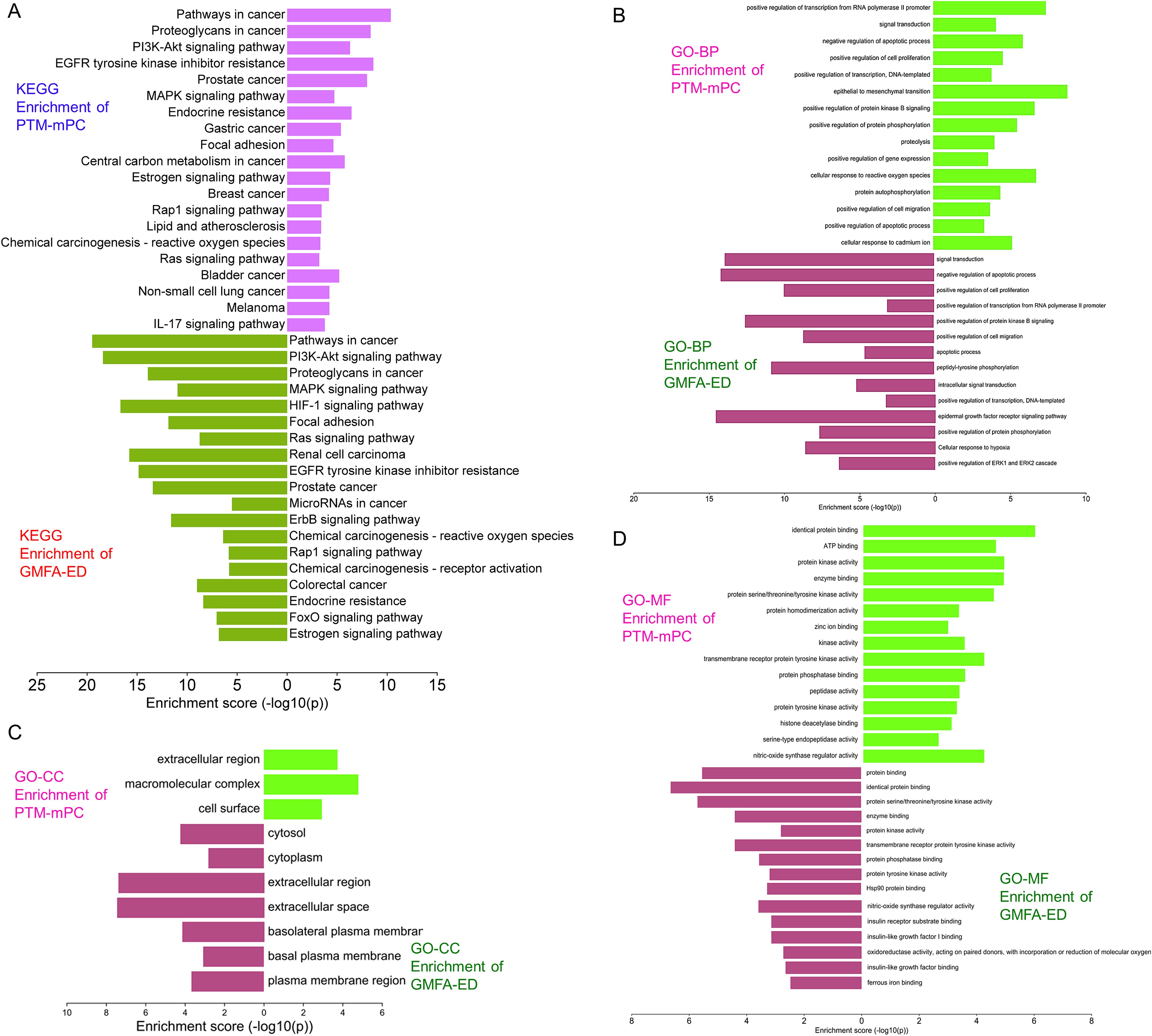

图9
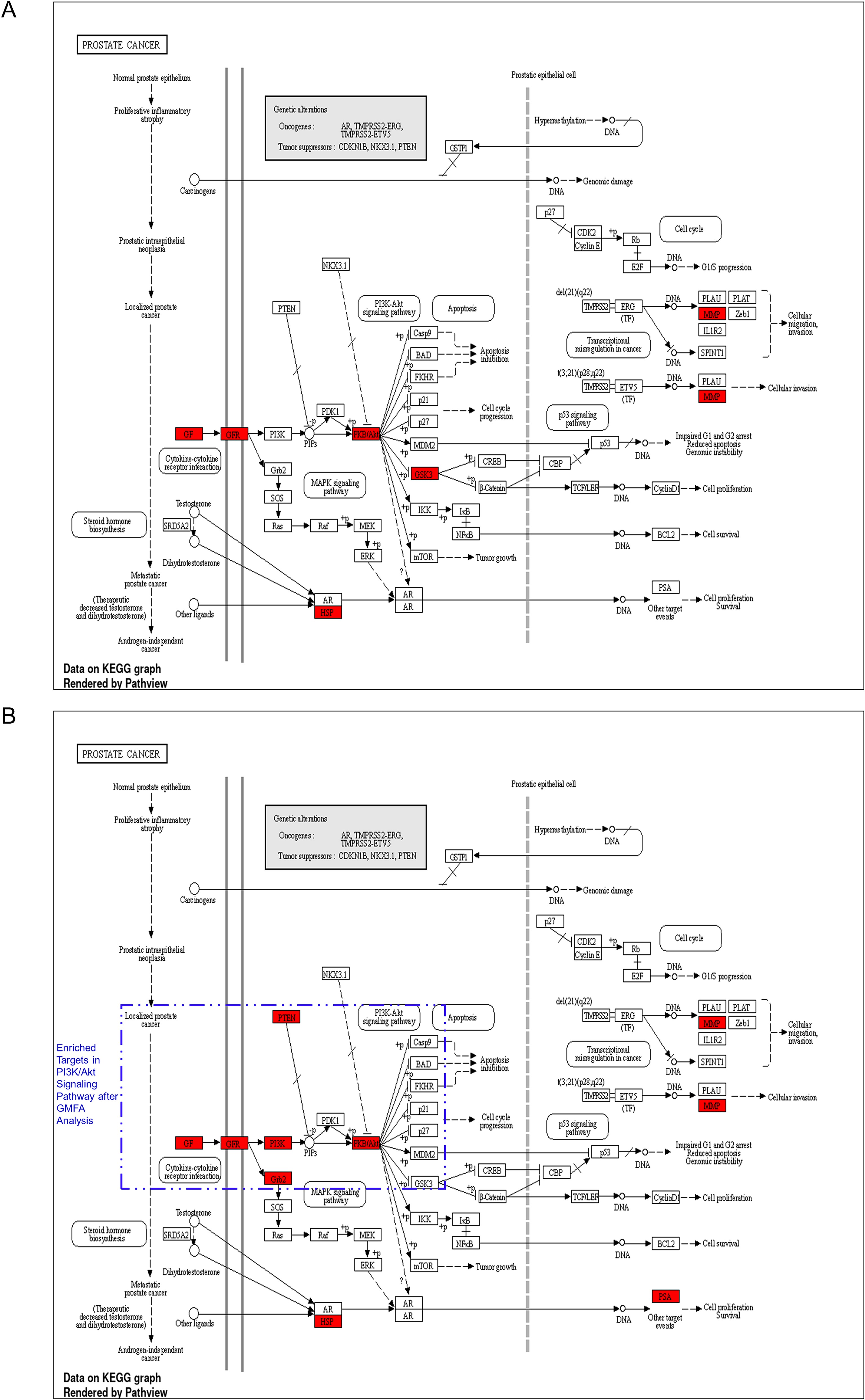
图10
8、MAT预测的PI3K/AKT信号通路靶标的分子对接和分子动力学模拟研究
作者选择了在mPC中起关键作用的PI3K/Akt信号通路的关键成分进行全面的分子对接和模拟研究。由IGF1、HGF和EGF等生长因子引发的PI3K信号激活会导致AKT驱动级联的下游激活。MAT对PI3K/Akt通路中的成分具有显著的亲和力(图11),显示出较低的亲和力。与IGF1R(-8.1 kcal/mol)、PI3KCA(-7.5 kcal/-mol)、PTEN(-7.1 kcal/mol)和AKT1的结合能。值得注意的是,PI3K/AKT信号通路中的其他靶点先前也进行了分子对接和MD模拟研究,这是PTM-mPC确定的前10个中心靶点分析的一部分。对接研究中的前三个复合物进行了MD模拟。PI3KCA主干原子的RMSD分析表明,与PI3KCA-CL复合物相比,PI3KCA-MAT复合物的平均RMSD略高于PI3KCA-CL(图12)。RMSF分析表明,两种复合物中环路区域(250-500)内残基的侧链原子都有明显波动。MAT始终形成5个一致的氢键,而CL形成3个氢键,偶尔达到maximum值5个。就IGF1R复合物而言,IGF1R-MAT复合物的RMSD偏差很大,而IGF1RCL复合物的RMSD保持稳定,但略微偏高。两者的RMSF除了末端残基和残基~950-1000。两种复合物的Rg最初都有偏差,稳定在2.5nm左右。MAT形成了4个稳定的氢键,而CL在最初10毫微秒内最多形成5个氢键,之后偶尔形成2个氢键。在PTEN复合物中,RMSD在50ns后趋于稳定,平均为0.3nm,侧链原子的波动与apo和PTEN-MAT复合物相似。Rg在最初出现偏差后稳定在2.25nm,MAT在整个过程中偶尔形成2个氢键。
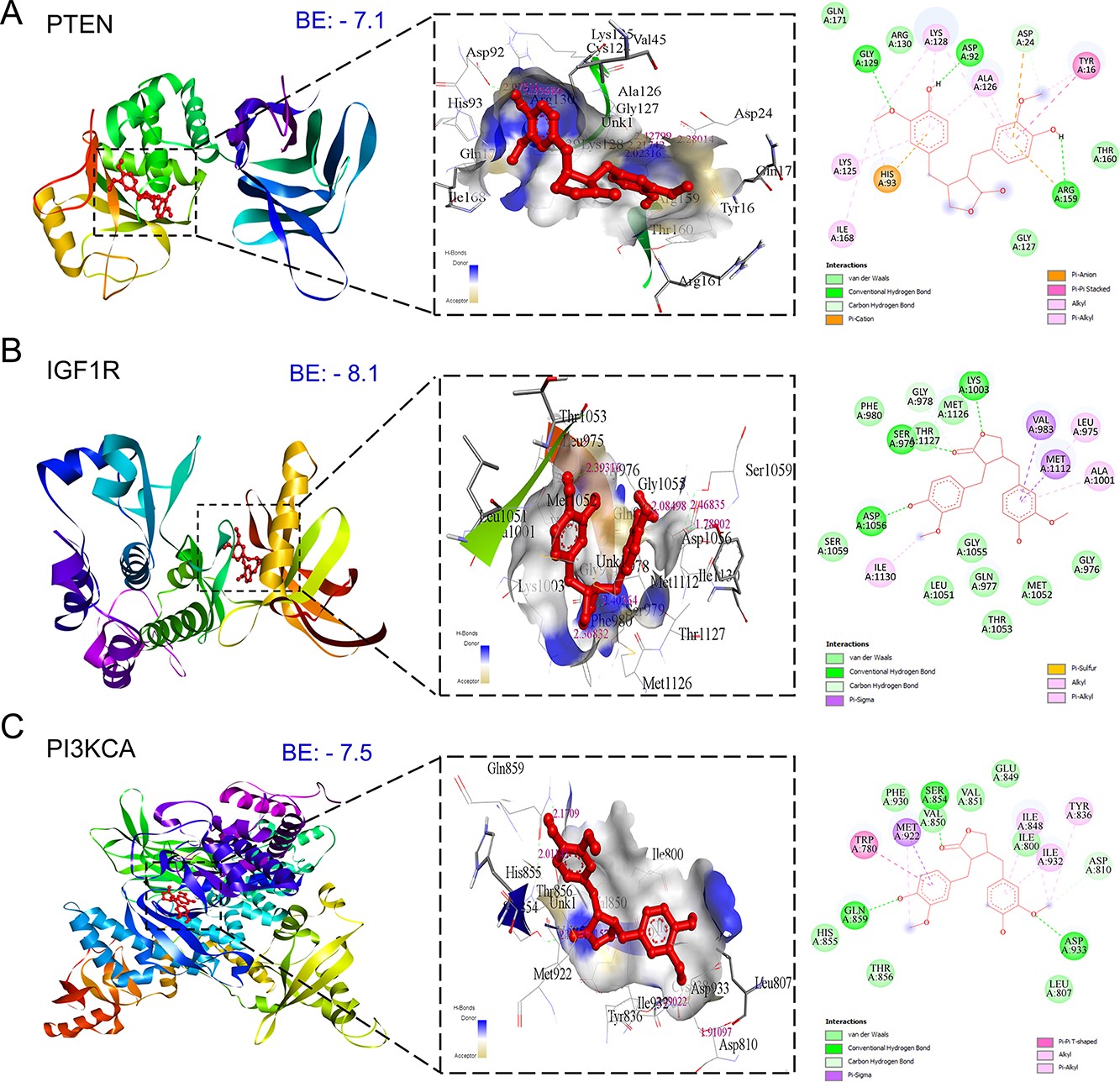
图11

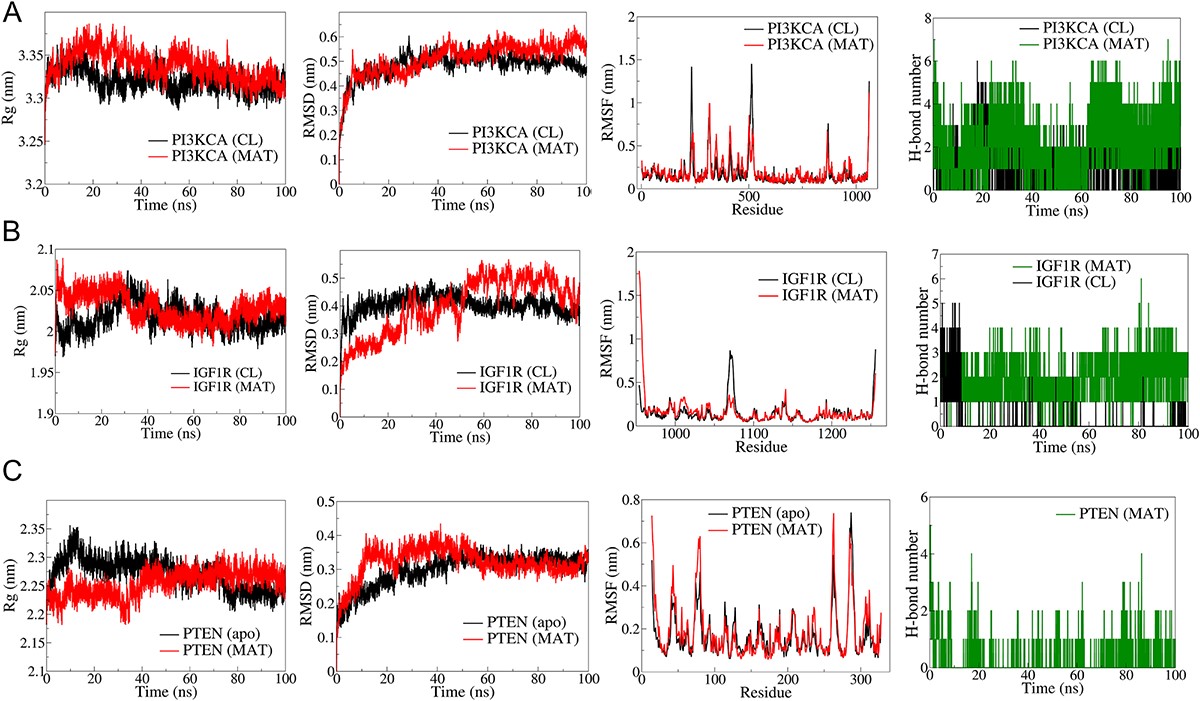
图12
9、MAT对PC3细胞具有抗癌活性,抑制了PC3细胞的克隆生成能力
MAT对PC3细胞的抗增殖作用是在24、48和72小时内通过MTT试验进行评估的(图13A)。在特定时间间隔(24、48和72小时)内,MAT处理后细胞存活率的降低呈剂量依赖性,这证实了MAT对转移性PC3前列腺癌细胞的抗癌潜力。细胞克隆形成实验表明,MAT抑制了PC3细胞的克隆生成能力,MAT的影响可直观地显示出来(图13B),随着MAT浓度的增加,细胞集落和细胞数量减少(图13C)。定量分析显示,克隆生成性的降低与剂量有关,MAT剂量为50μM(1.196倍)、100μM(1.44倍)和200μM(2.097倍)时,克隆生成性显著降低(图13D)。
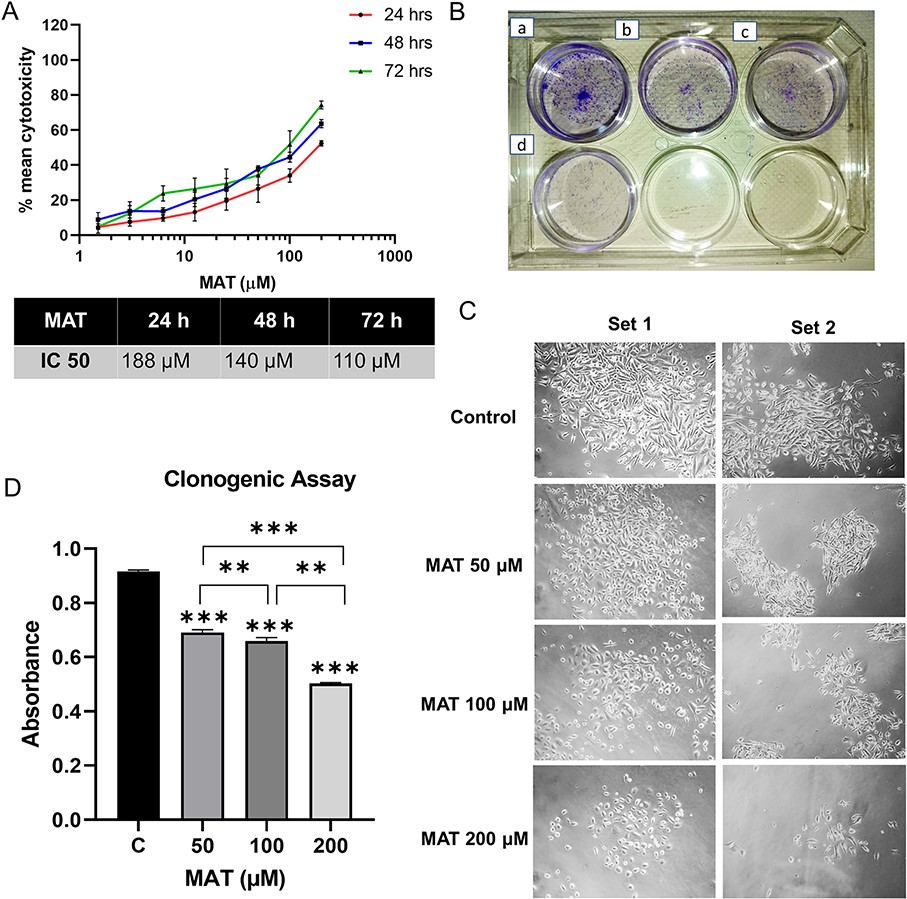
图13
10、MAT可抑制PC3前列腺癌细胞的迁移,减少基于肌动蛋白的片层和丝状细胞的形成
伤口愈合试验评估了PC3细胞的迁移,结果表明MAT处理对细胞迁移的抑制作用呈剂量依赖性(图14A)。相比之下,50、100和200μM的MAT处理可抑制迁移,使开放伤口面积百分比达到10.99%、经ImageJ软件分析量化,分别为24.48%和71.33%。位于细胞表面的富含肌动蛋白的结构(即丝状体和片状体)通过促进ECM重塑,在转移过程中发挥着关键作用。肌动蛋白细胞骨架的动态协调着细胞的运动和侵袭,对癌症的转移级联起着重要作用。TRITC-鬼笔环肽染色实验表明,在MAT处理24小时后,丝状突起和片状突起的形成明显减少,且呈剂量依赖性(图14B)。

图14
11、通过qPCR分析,MAT在mRNA水平下调了枢纽靶标
MAT处理明显改变了PC3细胞中关键基因的mRNA表达水平(图15)。值得注意的是,MAT降低了AKT1、ERBB2、MMP2、MMP9、HSP90AA1、HIF1A和IGF1R的mRNA水平、同时增加了PTEN的表达,PTEN是PI3K/AKT信号转导的调节因子。表皮生长因子受体和METmRNA水平基本不受影响。这些研究结果支持MAT靶向酪氨酸激酶受体,尤其是ERBB2和IGF1R,并调节PI3K/AKT通路,表明它对MMP相关转移性前列腺癌具有潜在疗效。
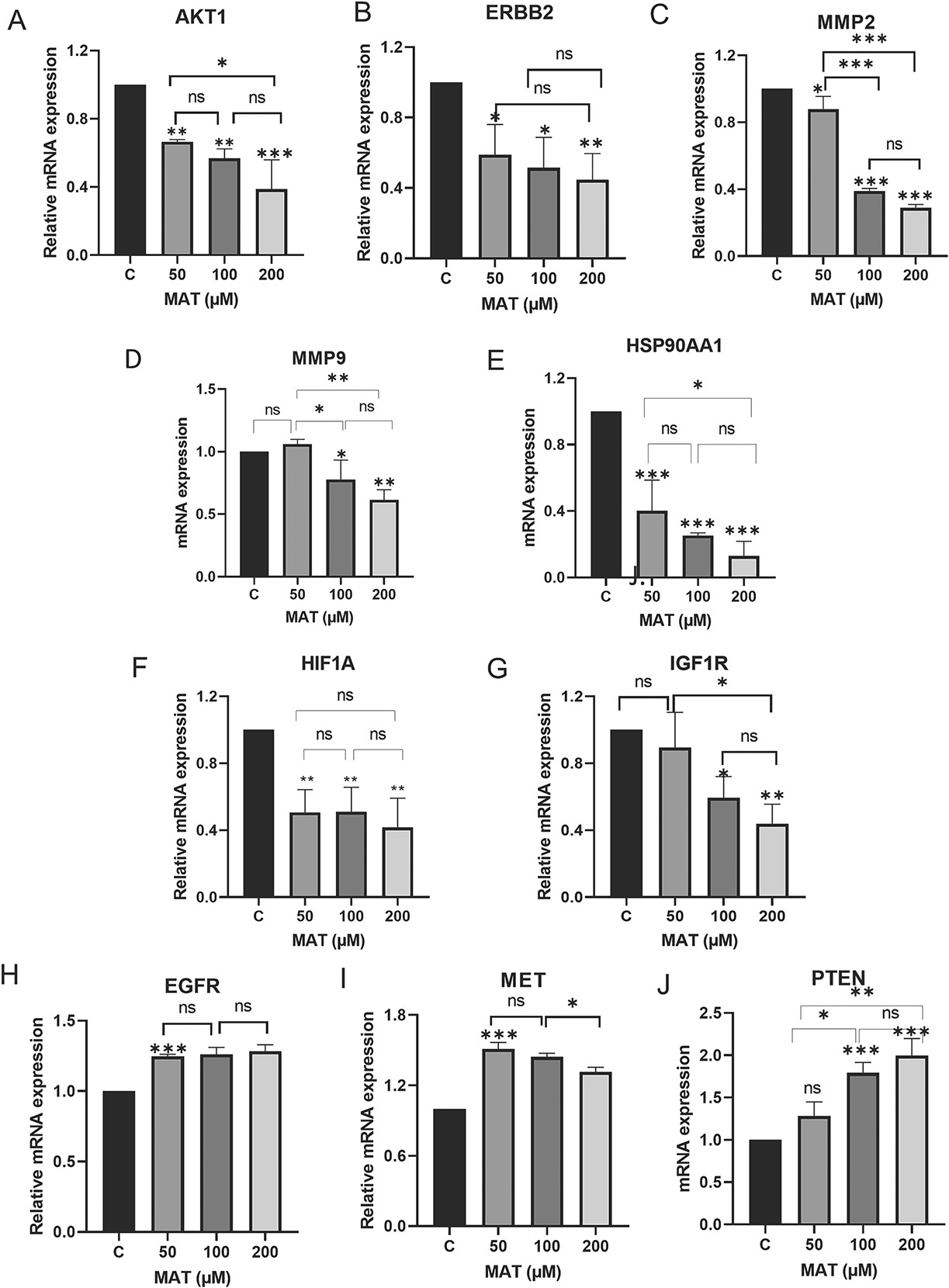

图15
总结:本文通过网络药理学+分子对接+分子动力学模拟+细胞实验验证,筛选了MAT针对mPC的治疗靶点,阐明了它们在MAT抗mPC转移潜能中的作用,思路清晰,傲星生物有丰富的分析方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




