IF12.4,单细胞分析揭示了乳腺癌亚型形成过程中的模拟进化!!
题目:单细胞分析揭示了乳腺癌亚型形成过程中的模拟进化
英文名:Single-cell analyses reveal evolution mimicry during the specification of breast cancer subtype
杂志:Theranostics
影响因子:12.4
发表时间:2024年05月19日
研究背景:干细胞或祖细胞的前身通过遗传和表观遗传程序赋予癌细胞发育的可塑性和独特的细胞特性。目前还没有利用新技术对乳腺癌的起源细胞进行全面鉴定和绘图,以揭示新的亚型特异性治疗靶点。
研究思路:通过公共数据库整合了来自正常乳腺组织的195,144个高质量细胞和来自原发性乳腺癌样本的406,501个高质量细胞,创建了人类正常乳腺和癌症乳腺的大规模单细胞图谱。通过将癌细胞与参考正常上皮细胞进行对比,探索了恶性细胞的潜在异质性来源。通过多组学分析以及体外和体内实验,筛选并验证了潜在的亚型特异性治疗靶点。在的队列中,通过免疫组化验证了已确定的免疫和基质细胞亚群的新型生物标记物。基于癌细胞起源模式的肿瘤分层与临床结果、基因组畸变和不同的微环境构成相关。发现管腔祖细胞(LP)亚型与预后不良、基因组不稳定和免疫微环境失调密切相关。然而,LP亚型患者对新辅助化疗(NAC)、PARP抑制剂(PARPi)和免疫疗法敏感。通过体外和体内实验研究了LP亚型特异性靶点PLK1。此外,乳腺癌的大规模单细胞图谱分析启发识别了一系列与临床相关的免疫和基质细胞亚群,包括先天性淋巴细胞(ILCs)、巨噬细胞和内皮细胞亚群。
研究结果:
1、人类正常乳房和癌变乳房的大规模综合细胞图谱
为了生成全面的单细胞转录信息,从公开数据集(图1A)中收集并分析了35个正常乳腺组织和181个原发性乳腺癌样本的scRNA-seq数据,并绘制了正常乳腺组织和癌变乳腺组织的转录图谱。经过质量控制和数据预处理后,共有195,144个来自正常乳腺组织的高质量细胞和406,501个来自原发性乳腺癌样本的高质量细胞被纳入的分析(图1A)。为了确定正常乳腺组织细胞成分的特征,在校正了不同数据集的批次效应后,对所有细胞进行了基于图的无监督聚类(图1B)。所有主要细胞类型,包括三个上皮亚群(BM、LP和ML)、免疫细胞、内皮细胞、成纤维细胞和周细胞,都根据标准细胞标记进行了注释,并通过UMAP进行了可视化(图1B-C)。在肿瘤区室中,除了上皮细胞、内皮细胞、成纤维细胞和周细胞外,还发现了丰富的免疫亚群,包括T细胞、B细胞、浆细胞和髓系细胞,它们具有独特的细胞特征(图1D-E)。
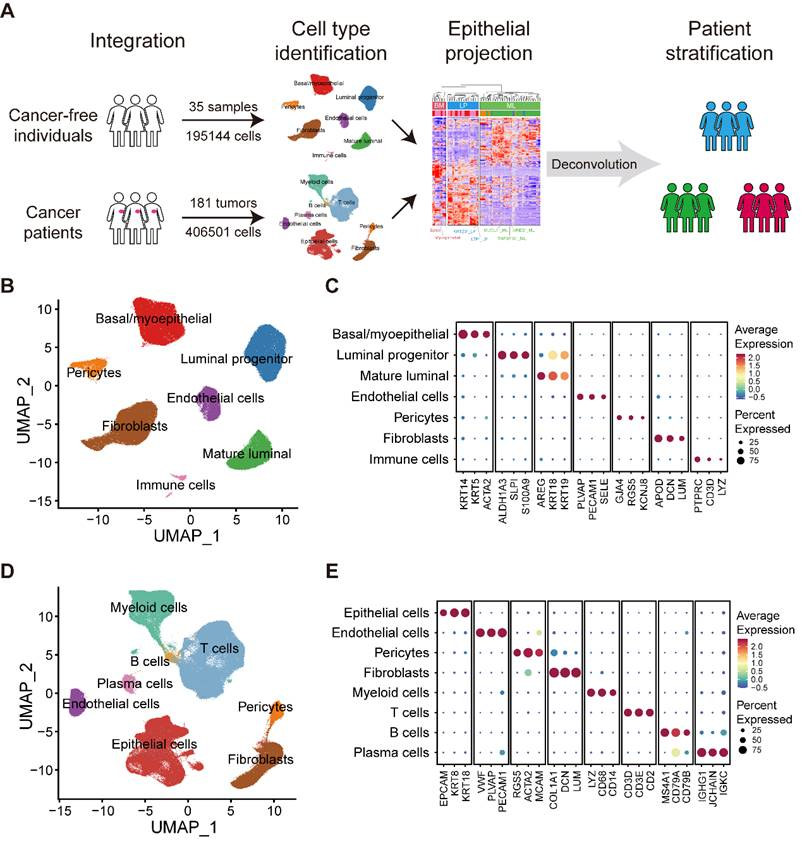

图1
2、乳腺癌细胞与正常乳腺上皮细胞亚型的配准
上述分析表明,正常乳房有三个上皮细胞大群,即BM、LP和ML亚群,并根据不同基因特征的表达确定了七个次要亚群(图2A)。根据癌细胞起源模式和内部异质性,整个肿瘤细胞被分为20个亚群,并通过UMAP进行可视化(图2C)。利用ROGUE分析观察到LP组的癌细胞在三大亚组中表现出highest的异质性(图2D)。为了了解这些肿瘤细胞群的基因组变化,使用inferCNV算法估算了单细胞拷贝数变异(CNVs),结果显示LP组的恶性肿瘤细胞表现出明显的高CNV水平(图2E)。此外,为了确定这些亚群的生物学特性,按照之前的描述确定了癌细胞的复发状态(图2F)。此外,还利用标志基因组研究了这些亚群的功能异质性。雌激素反应相关基因的表达在ML亚型中富集(图2G)。总之,根据癌细胞起源模式确定了乳腺癌细胞的三种分子亚型,并对每种分子亚型中的癌细胞状态和功能异质性进行了细致的表征。
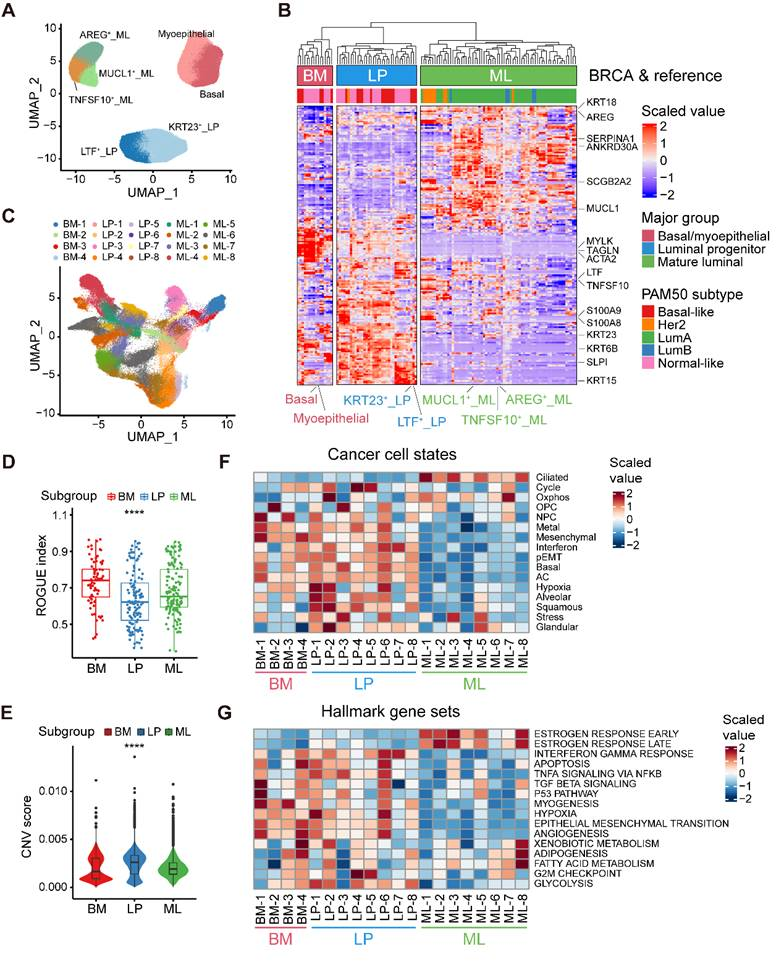
图2
3、LP亚型乳腺癌的分子和临床特征
为了确定已确定的癌细胞起源模式的临床相关性,首先在METABRIC队列中进行了去卷积分析,去卷积样本呈现出显著的瘤内异质性(图3A)。LP亚型与不良预后明显相关,且与年龄、肿瘤分级、肿瘤大小、肿瘤分期、肿瘤突变负荷(TMB)和细胞周期评分无关(图3B)。鉴于LP衍生癌细胞的CNV负担较高,进一步探讨了TCGA数据集中LP为主的恶性肿瘤与基因组改变特征之间的关系。与单细胞分析推断出的CNV负担增加相一致,LP亚型的肿瘤显示出较高的TMB水平,尤其是以下肿瘤COSMIC突变特征SBS3(与同源重组缺陷(HRD)有关)和SBS13,而非SBS2(均与APOBEC基因突变有关)介导的脱氨(图3C)与HRD相关的复杂基因组改变事件(HRD评分)在LP评分较高(LP-高)的乳腺肿瘤中也显著升高(图3D)。值得注意的是,LP高患者对NAC和PARPi治疗敏感(图3E-F)。综上所述,这些研究结果表明,LP亚型乳腺癌具有较高的TMB和基因组不稳定性,但对NAC和PARPi治疗敏感。接下来探讨了临床队列中LP亚型乳腺癌的功能和免疫特征。基因组富集分析(GSEA)显示,LP亚型的转录特征富集于γ干扰素反应、炎症反应、细胞因子-细胞因子受体相互作用和先天性免疫系统通路(图3G)。然而,LP高的肿瘤表现出T细胞衰竭特征评分和各种免疫抑制检查点表达水平的升高(图3H)。此外,还发现,在I-SPY2队列中,LP亚型患者更有可能在ICB联合NAC治疗后获得pCR(图3I)。为了确定PSAT1状态与临床进展之间是否存在关系,对乳腺癌组织芯片进行了IHC染色。结果显示,PSAT1染色主要呈细胞质状(图3J),PSAT1过表达表明无病生存期(DFS)较差。利用这些生物标记物,的IHC队列将LP分子亚型定义为PSAT1高/ER低/CK14低(图3J),LP组显示预后较差(图3K)。综上所述,发现了LP亚型乳腺癌具有明显的低预后、特殊的分子和临床特征,并进一步筛选和验证了候选标志物,为临床实践提供了依据。
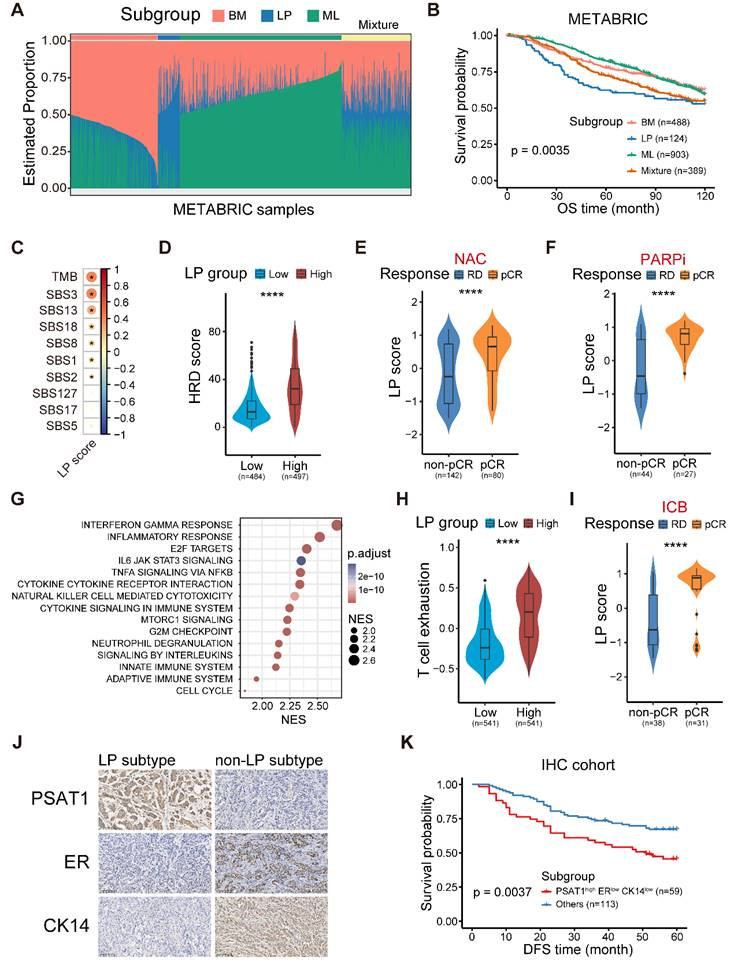
图3
4、确定LP亚型乳腺癌的潜在治疗靶点
考虑到染色体畸变是乳腺癌LP亚型的显著特征,接下来致力于探索染色体不稳定性的主要相关因素,并将其作为LP亚型的潜在治疗靶点,这涉及到不同的全局组学领域。结合本研究中通过整合单细胞和大容量RNA-seq分析得出的假定参与者,以及最近通过基因组规模的Perturb-seq调查发现的基因,成功地阐明了包括PLK1、TPX2、CDK1和AURKA在内的260个候选基因群(图4A-B)。此外,还利用GSVA技术计算了一系列乳腺癌细胞系的LP特征得分。精心鉴定出SUM-149PT是典型的LP亚型乳腺癌细胞系,而MCF-7。则是典型的非LP乳腺癌对照细胞系(图4C)。为了筛选出参与LP亚型乳腺癌染色体不稳定的主要因素,初步发现,抑制PLK1、TPX2、CDK1和AURKA对肿瘤细胞的增殖产生了不同的影响,这一点可以从所观察到的渐变中看出(图4D)。选择PLK1作为阐明LP亚型复杂性的关键因素。观察到,抑制PLK1大大增强了SUM-149PT细胞的凋亡过程,而对MCF-7细胞的凋亡没有明显影响(图4E)。细胞遗传学调查显示,SUM-149PT细胞在经历PLK1损伤后,染色体畸变的频率增加,包括染色体截断和断裂等现象(图4F)。而在受到类似PLK1抑制的MCF-7细胞中却没有发现这种现象(图4F)。此外,还在小鼠模型中评估了PLK1对肿瘤生长的影响。值得注意的是,与对照载体细胞相比,发现抑制了PLK1的SUM-149PT细胞的肿瘤扩张速度减慢了(图4G-I)。值得注意的是,在volasertib处理下,SUM-149PT细胞(而非MCF-7细胞)的细胞增殖受到明显抑制,同时凋亡诱导也显著增强(图4J-K)。在SUM-149PT小鼠模型中,观察到服用volasertib后肿瘤生长也有类似的减弱(图4L-N)。综上所述,这些结果表明PLK1有可能是LP亚型乳腺癌中染色体不稳定性的一个基本因素,因此成为LP亚型乳腺癌领域中一个值得探索的治疗靶点。
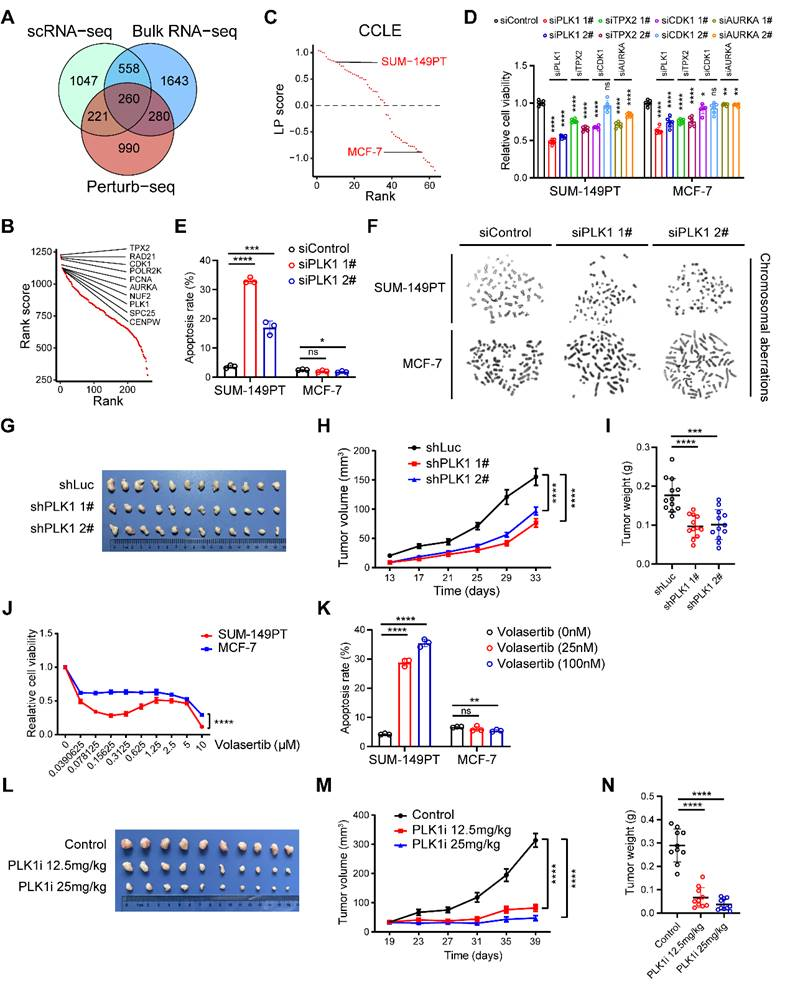
图4
5、淋巴细胞、自然杀伤细胞(NK)和先天淋巴细胞(ILC)的综合分析
鉴于不同分子亚型乳腺癌的免疫微环境各不相同,接下来的目标是通过整合scRNA-seq技术和生物信息学方法,构建高分辨率的乳腺癌免疫细胞图谱。首先,整合了156289个T细胞和NK/ILCs,确定了24个集群,其中包括7个CD4+T集群、8个CD8+T集群、6个循环T集群和3个NK/ILCs集群(图5a)。然后,根据标记基因的表达和功能特征对这些集群进行了注释(图5B)。所有主要细胞类型都有代表,并且在不同的分子亚型中表现出不同的比例(图5C)。为了探索这些集群的生物学特征,对不同亚群的幼稚型、细胞毒性型、衰竭型和调节型T细胞特征进行了初步评分(图5D)。为了深入了解NK/ILC的组成,重建了NK/ILC的聚类,并确定了三个主要亚群,包括两个NK细胞群和一个新的ILC3细胞群(图5E)。FGFBP2+NK细胞显著表达细胞毒性和效应标志物,如FGFBP2、FCGR3A和PRF1,并显示出细胞溶解和吞噬途径的富集(图5F-G)。最后,研究了这种新型IL7R+ILC3集群的预后价值,发现IL7R+ILC3集群的高组成与较长的无复发生存期(RFS)密切相关(图5H),这表明这种新型ILC3集群可作为乳腺癌的一种可靠的预后生物标志物。
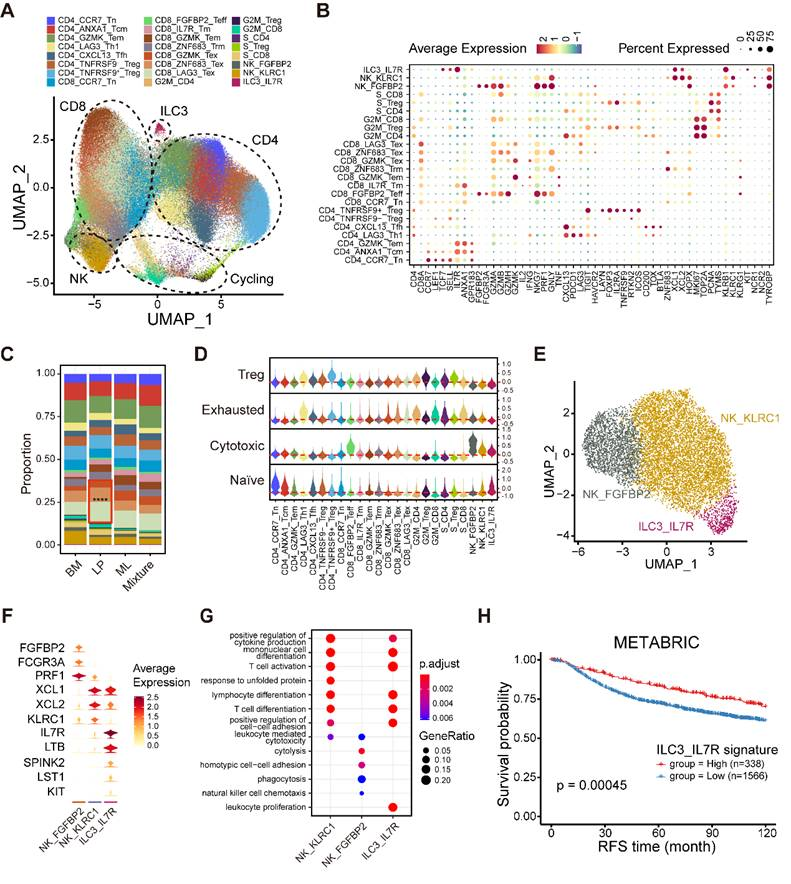
图5
6、乳腺癌中的髓样细胞异质性
为了进一步确定乳腺肿瘤微环境(TME)中髓样细胞的异质性,分析了52,955个髓样细胞的scRNA-seq数据,并基于无监督图谱将其聚类为19个基于典型细胞标记的次要亚群(图6A-B)。主要细胞系包括肥大细胞、树突状细胞(DC)、单核细胞、巨噬细胞和循环髓系细胞(图6A)。肥大细胞的特点是特异性高表达TPSAB1、TPSB2和KIT,在ML亚型样本中含量丰富(图6B-C)。根据经典细胞标记物的表达,DCs被分为多种亚型,包括传统的1型和2型DCs(cDC1s、cDC2s)、迁移性DCs(mDCs)、类浆。细胞DCs(pDCs)和非典型DCs(nc-DCs)(图6AB和图S9A-B)。CD1A+cDC2集群rare地存在于ML亚型样本中,并特异性表达朗格汉斯细胞标志物,如CD1A和CD207(朗格林),这表明该集群代表朗格林+DCs(图6C)。随后,巨噬细胞形成了七个亚群,它们具有不同程度的"经典活化"M1样和"替代活化"M2样巨噬细胞特征得分(图6D)。据报道,在这些巨噬细胞亚群中,SPP1+TAM和C1QC+TAM这两个TAM亚群表现出TAM的二分功能表型(图6D)。此外,还发现了一个C1QC+CLEC10A+TAM亚群,它可能是类DCTAMs,具有HLA基因(HLADQA2和HLA-DQB1)、CLEC10A和CD1E的过表达。以及比经典DC更高的TAM特征得分(图6B、D)。值得注意的是,ML亚型样本中富集的新型巨噬细胞亚群的特点是肌酸激酶脑同工酶(CKB)表达升高(图6C-E)。CKB是肌酸激酶家族的成员,可在ATP和肌酸之间可逆地转移高能磷酸基团,生成磷酸肌酸和ADP。使用GSVA进行的通路富集分析表明,氧化磷酸化和细胞外基质(ECM)受体相互作用在CKB+巨噬细胞亚群中富集(图6F)。
在METABRIC队列中,较高的CKB+巨噬细胞组成和较高的CKB表达均与生存劣势有关,IHC结果进一步验证了CKB+细胞的增加表明DFS较差(图6G-H)。在接受ICB治疗的患者中,CKB+巨噬细胞的组成与免疫治疗耐药性和不良预后呈正相关(图6I)。总之,这些数据说明了乳腺癌中肿瘤浸润髓系细胞的情况,并表明所发现的新型CKB+巨噬细胞亚群可能对预测乳腺癌的预后和免疫治疗反应具有重要价值。
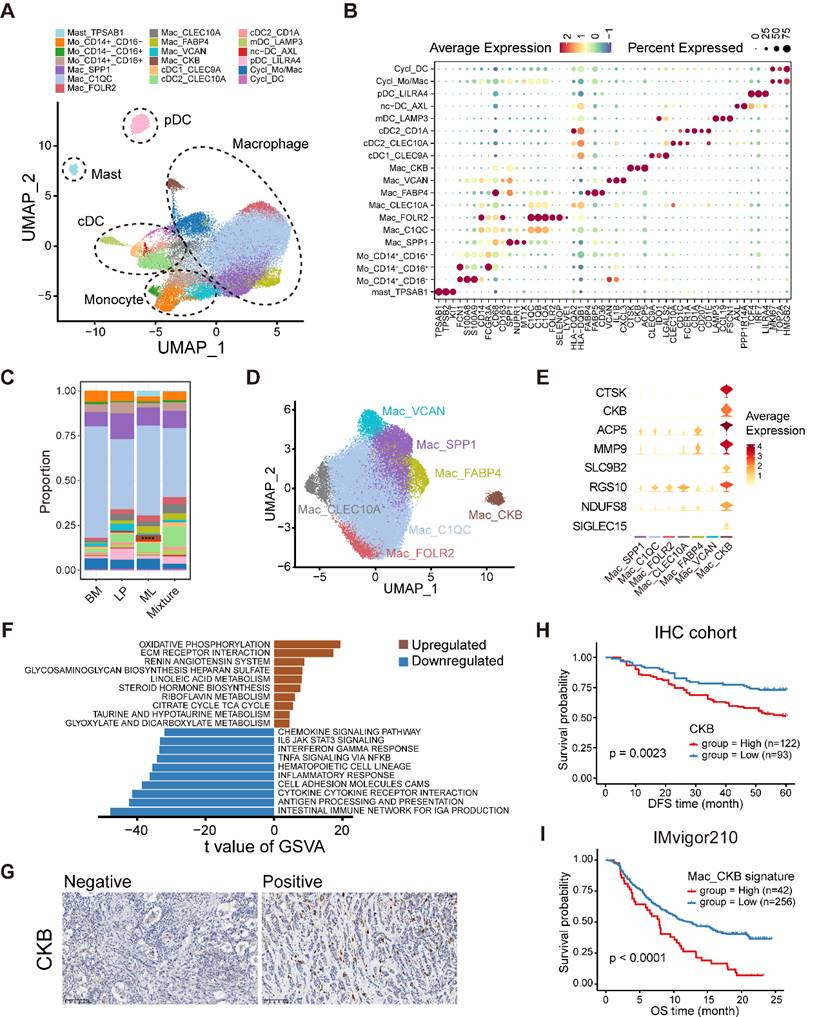 图6
图6
7、正常乳房和癌变乳房的基质区由不同类型的细胞组成
为了研究包括EC、成纤维细胞和周细胞(也称为类血管周细胞(PVL))在内的基质区的异质性,整合了正常乳房和癌症乳房的基质细胞,并校正了批次效应。首先,分析了33,529个(18,096个来自乳腺癌,15,433个来自正常乳房)内皮细胞,并鉴定了不同血管床(动脉、毛细血管和静脉)的不同淋巴管和血管(图7A)。根据保守标记注释了正常乳房和癌变乳房中的四个主要内皮分区(图7B)。令人惊讶的是,正常乳房和癌变乳房的内皮细胞未能均匀地混合在一起,显示出它们之间明显的生物学差异。在正常乳腺和癌变乳腺的同源内皮细胞中观察到了一系列不同表达的标记物。例如,PDPN和CCL21在正常乳腺和恶性乳腺的淋巴细。胞中均有过表达(图7B)。此外,AKR1C1只在正常乳腺组织的淋巴细胞中被发现,而LYVE1则在恶性肿瘤的淋巴细胞中明显表达(图7B)。为了进一步阐明乳腺癌中EC的异质性,首先进行了ROGUE分析。结果表明,在四个EC亚群中,毛细血管EC的异质性highest,然后,毛细血管细胞被进一步重新聚类为五个亚群(图7C)。此外,CA4+毛细血管内皮细胞明显表达与脂肪酸和甘油的摄取和代谢有关的标记物,包括FABP4、FABP5和CD36(图7D)。还确定了一种血管生成基因(PGF)表达较高的血管生成毛细血管EC(图7D)。观察到这些毛细血管内皮细胞亚型的比例存在差异,在ML亚型样本中发现CA4+毛细血管内皮细胞的比例明显下降(图7E)。在METABRIC队列中,CA4+毛细血管EC特征与优越的存活率相关(图7F)。此外,还进行了IHC分析,以确定患者生存率与CA4+毛细血管EC丰度之间的关系。在的队列中观察到类似的结果(图7G-H)。相比之下,血管生成毛细血管细胞丰度较高的患者生存期明显较短。此外,对血管生成抑制剂曲班尼(trebananib)敏感的患者表现出血管生成毛细血管细胞特征评分升高(图7I)。此外,还发现,对ICB治疗敏感的膀胱癌患者血管生成毛细血管EC的组成减少,且与不良预后相关(图7J-K)。总之,这些分析建立了EC的细胞图谱,可能有助于阐明乳腺癌中EC亚群的异质性、功能和临床意义。

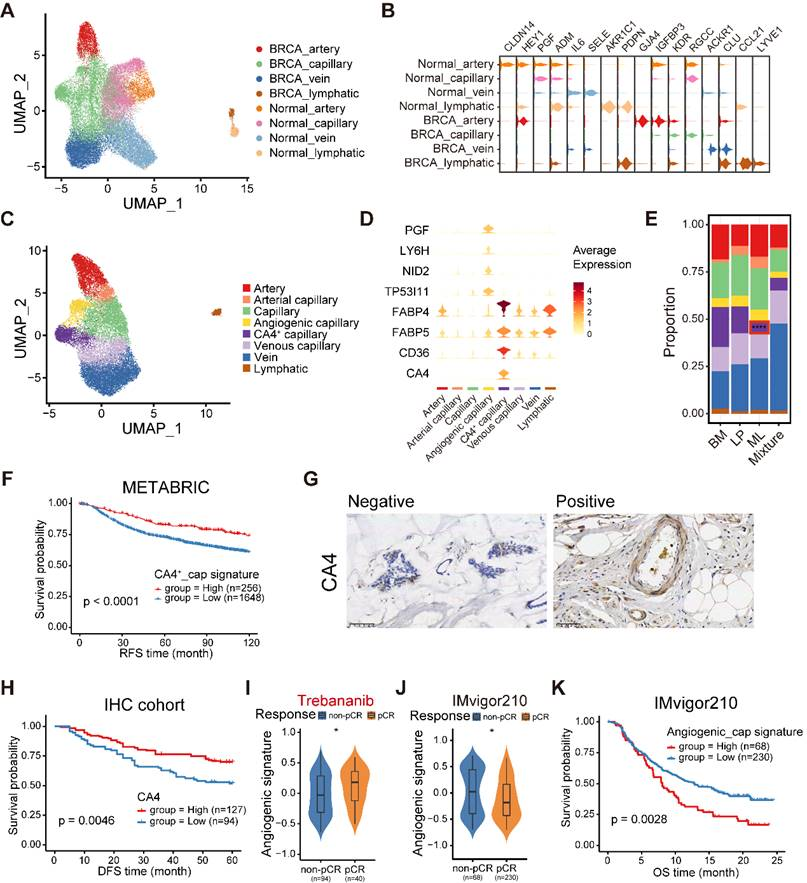
图7
总结:本文利用scRNA-seq和Bulk RNA-seq数据分析,分析结果实验验证,研究揭示了乳腺癌的细胞谱系和起源细胞模式。傲星生物有丰富的分析方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




