IF6.7/Q1,代谢组学和网络药理学揭示麝香保心丸抗动脉粥样硬化的作用机制!
题目:整合代谢组学和网络药理学揭示麝香保心丸抗动脉粥样硬化的作用机制
英文名:Integrated metabolomics and network pharmacology to reveal the mechanisms of Shexiang Baoxin pill against atherosclerosis
杂志:Phytomedicine
影响因子:6.7/Q1
发表时间:2024年10月11日
研究背景:动脉粥样硬化是一种以血管内皮发生脂质病变为特征的疾病,仍然是导致全球死亡的一个主要因素。麝香保心丸(SBP)已被用于治疗多种心血管疾病,但其复杂的作用机制仍不清楚。本研究旨在确定射香保心丸对动脉粥样硬化的潜在影响以及相关的潜在调控机制。
研究思路:利用网络药理学预测药物-疾病的关键靶点,并应用非靶点代谢组学分析鉴定关键代谢物和代谢途径。构建小鼠动脉粥样硬化模型以明确SBP对动脉粥样硬化的保护作用,并进行体内和体外试验以验证分析结果和明确SBP影响动脉粥样硬化的机制。结果显示结果表明,SBP在体内可通过降低血脂水平、斑块形成和内皮损伤发挥保护作用。网络药理学和代谢组学显示,MAPK3、AKT1和STAT3是枢纽靶点,三甲胺正氧化物(TMAO)是关键代谢物。由于TMAO具有致动脉粥样硬化的作用,因此研究人员在体外研究了SBP的相应保护作用。SBP抑制了TMAO诱导的内皮细胞凋亡和氧化应激,并抵消了MAPK3、AKT1和STAT3表达的上调。分子对接和酶抑制作用表明,SBP的活性成分能与关键靶蛋白稳定结合。
研究结果:
1、网络药理学分析
通过SwissADME和SwissTargetPrediction的筛选和预测,共发现了861个药物靶点,其中成分与靶点之间的对应关系如图1A所示。在至少两个数据库中筛选后,确定了843个动脉粥样硬化的疾病靶点(图1B)。药物与疾病靶点相互作用的维恩图见图1C。GO分析显示,CC项涉及膜筏和局灶粘附,MF项涉及核受体和内肽酶活性(图1D)。根据KEGG分析结果,脂质和动脉粥样硬化、细胞凋亡、PI3K-Akt和IL-17信号通路被强烈富集(图1E)。
接下来,作者构建了PPI网络并筛选出了中心基因(图1F)。图1G中显示了33个相关的TFs,其中关联度highest的是FOXC1、GATA2、YY1、HINFP、USF2、MAX和TFAP2A。在如图1H所示,基因-miRNA网络由与枢纽基因高度相关的miRNAs发挥作用:hsa-mir-19a-3p、hsa-mir-17-5p、hsa-mir-19b-3p、hsa-mir-20a-5p。上述中枢基因、TFs和miRNA可能在动脉粥样硬化中具有潜在的作用,随后进行了一系列实验来验证预测结果。
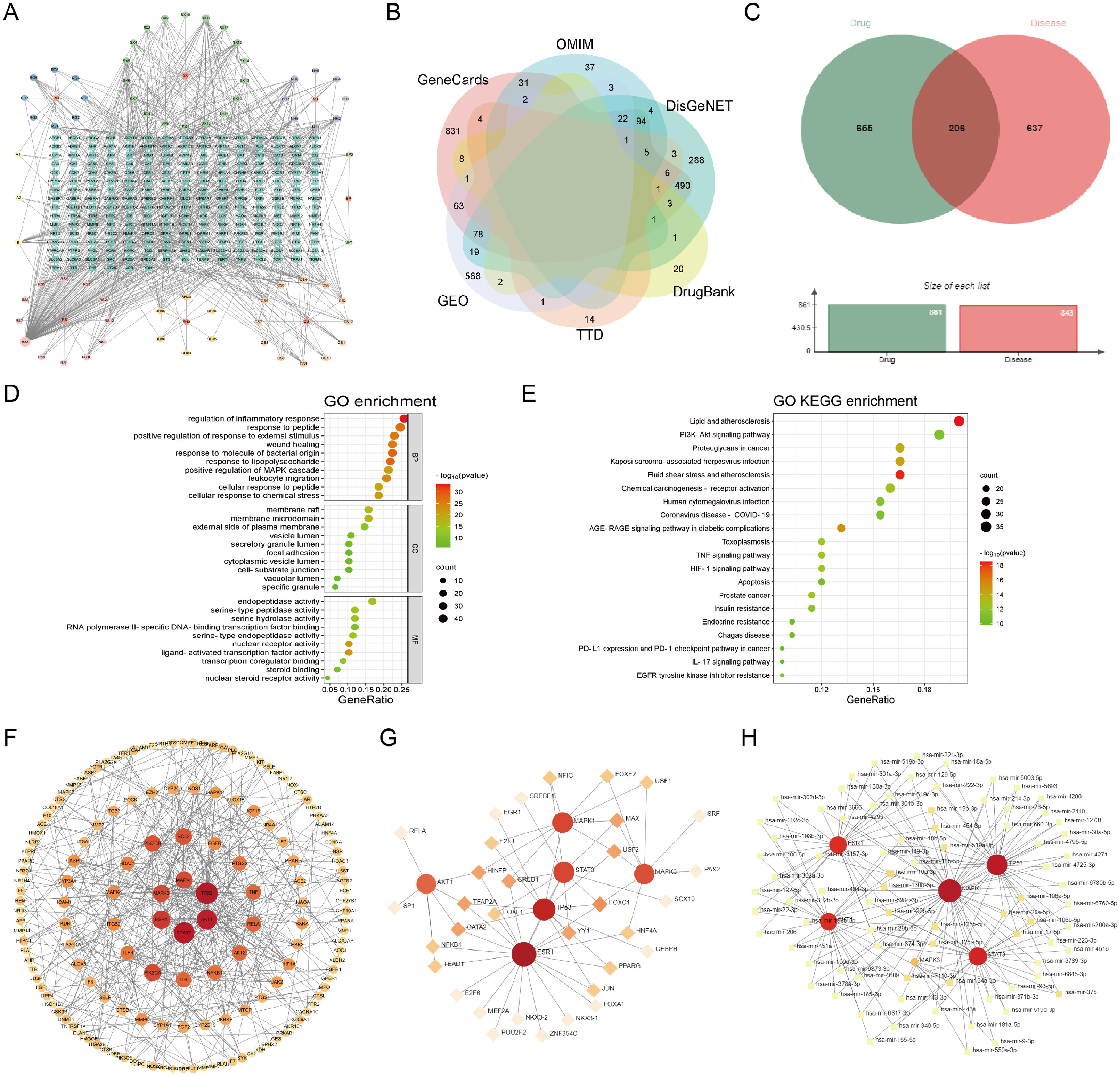
图1
2、SBP对血脂水平和动脉粥样硬化病变的影响
在整个实验过程中,每三周记录一次体重。在每组之间观察到没有统计学上的显着差异,这表明SBP不会干扰小鼠的食欲或能量消耗。与模型组相比,治疗组在SBP灌饲12周后TC、TG和LDL-C水平显着降低(图2A-C)。此外,ALT、AST和Urea水平在组间无显著差异,表明SBP对小鼠的肝或肾功能没有影响(图2D-F)。

图2
在组织病理学方面,最初通过量化主动脉斑块病变的尺寸来检查SBP对AS的影响。在模型组中,反映主动脉粥样硬化程度的油红O染色区域的百分比远高于对照组,而SBP抑制了这种变化(图3A)。此外,主动脉根部病变面积和胶原蛋白含量与H&E和Masson染色也是评估AS的关键指标,显示SBP表现出病变面积和胶原蛋白含量增加的显着逆转(图3B-C)。因此,这些结果表明SBP通过减少脂质积累和抑制主动脉斑块形成来改善AS。
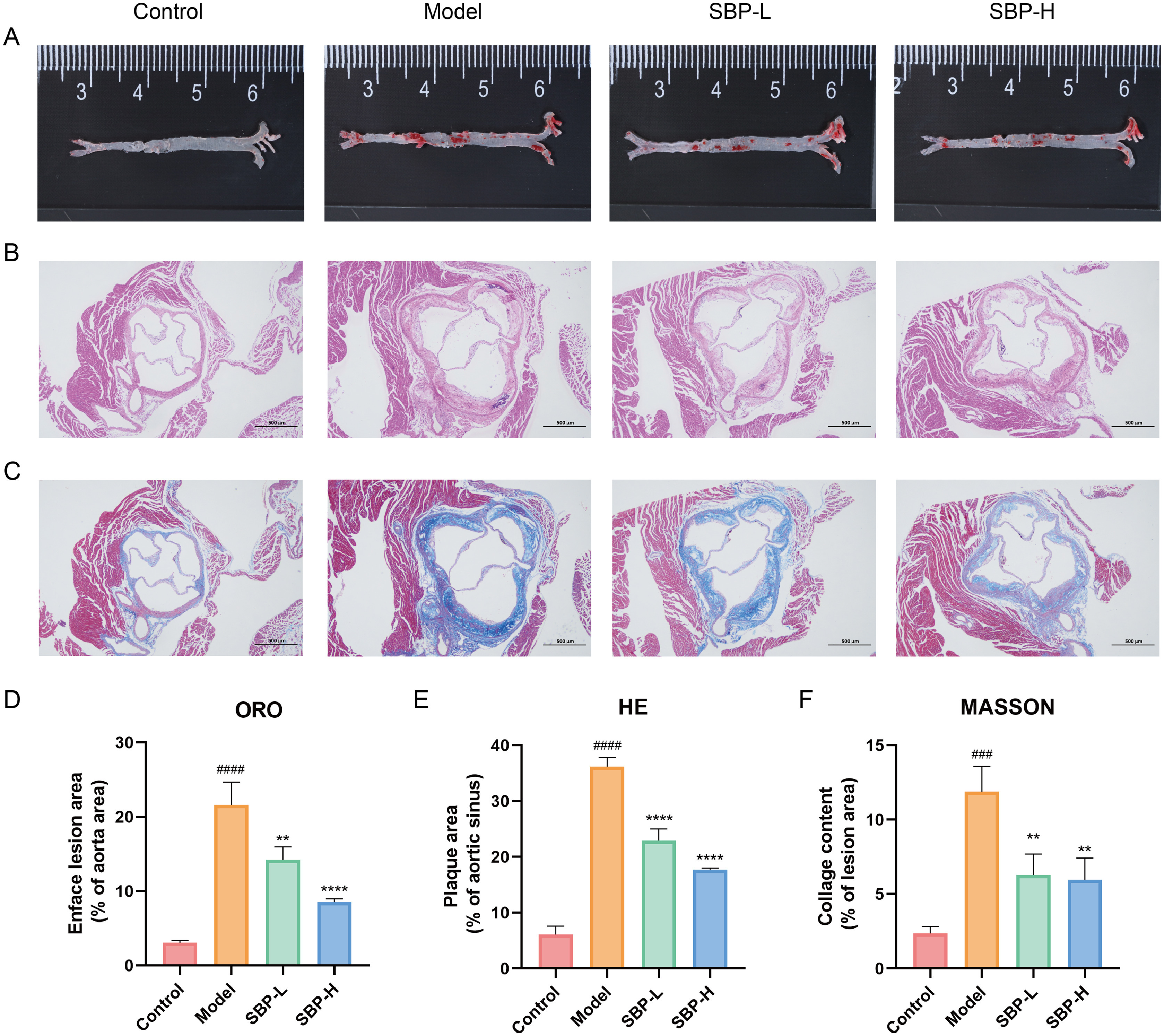
图3
3、潜在的差异代谢物筛选和通路富集
为了研究SBP对动脉粥样硬化的代谢影响,对小鼠血清样本进行了代谢组学测定和分析。PCA是一种降尺度数据分析方法,它将最初鉴定出的代谢物进行线性重组,形成一个新的复合变量。在对照组、AS组和SBP组中,组间分离明显,组内聚集严重(图4A)。评价参数R2X、R2Y和Q2表明OPLS-DA具有良好的鲁棒性,不会出现过度拟合现象(图4B-C),因此适用于代谢物和通路分析。
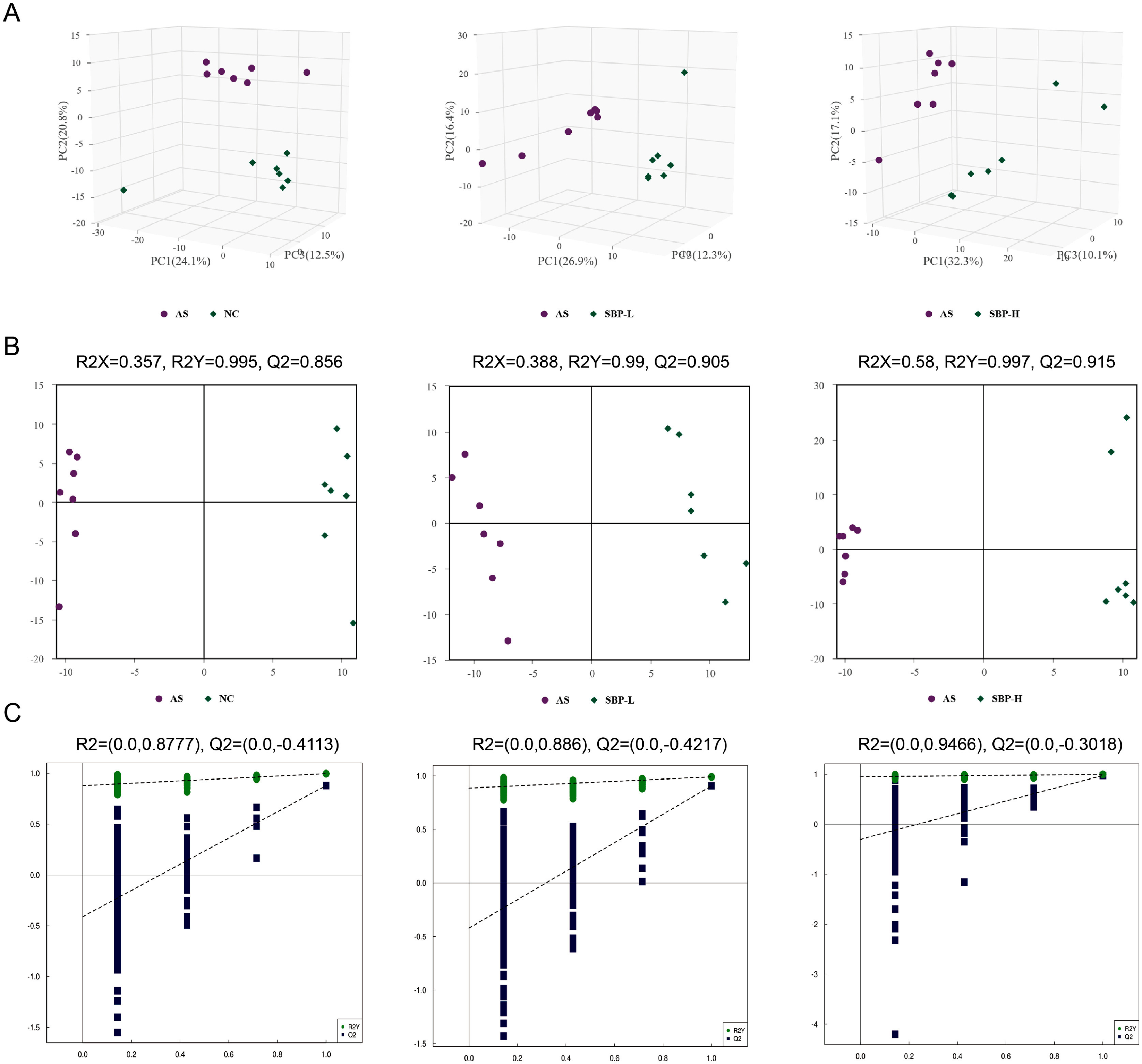
图4
为便于后续分析,两个SBP剂量的数据合并为一组。对比对照组和AS组,得到了39个不同的代谢物。同样,AS组和SBP组也得到了64个不同的代谢物。这两种情况的交集产生了32个差异代谢物,它们是本研究的关键代谢物(图5a-C)。此外,还发现了七条代谢途径,包括亚油酸代谢、类固醇激素生物合成、肌醇磷酸代谢、鞘脂代谢、甘油磷脂代谢、类固醇生物合成和初级胆汁酸生物合成(图5D-F)。根据代谢组学分析,作者确定了可能影响动脉粥样硬化治疗过程中代谢状态的4种代谢物和SBP对经TMAO处理的HUVEC的迁移、凋亡和氧化应激的影响7条代谢途径。
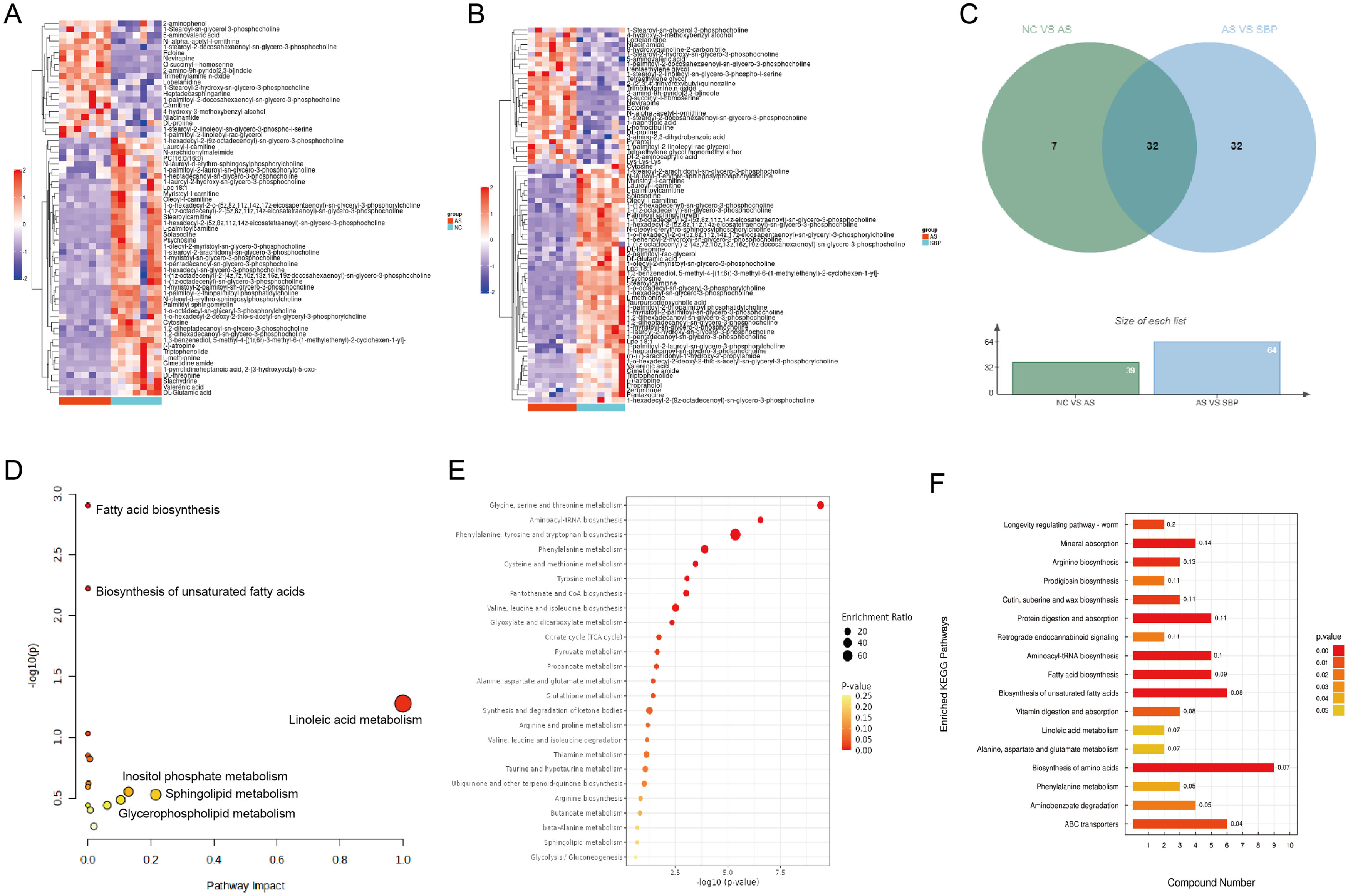
图5
4、SBP对TMAO处理的HUVECs迁移、凋亡和氧化应激的影响
对初始组和划痕后24小时处理组的伤口面积进行了量化和比较,结果表明TMAO抑制了细胞迁移,而相反地在SBP组中观察到细胞迁移模式。这一发现表明,在刺激条件下,SBP与TMAO一样能抵消对细胞迁移的抑制(图6A-B)。研究表明,内皮细胞凋亡与ROS的产生密切相关。为了揭示TMAO和SBP对内皮细胞凋亡的影响,使用了流式细胞术。根据图5C中红色部分显示,TMAO增加了早期和晚期凋亡细胞的比例。服用SBP后,凋亡细胞的比例下降,表明SBP抑制了TMAO诱导的细胞凋亡(图6C-D)。此外,由于氧化应激是导致动脉粥样硬化恶化的重要因素,研究了SBP是否参与了细胞内ROS的清除。TMAO明显增加了HUVECs中的ROS水平,而SBP阻止了这些变化并降低了内皮氧化应激(图6E-F)。这些结果表明,SBP可抑制TMAO诱导的HUVEC细胞凋亡和氧化应激,并减轻TMAO对细胞迁移的抑制作用。
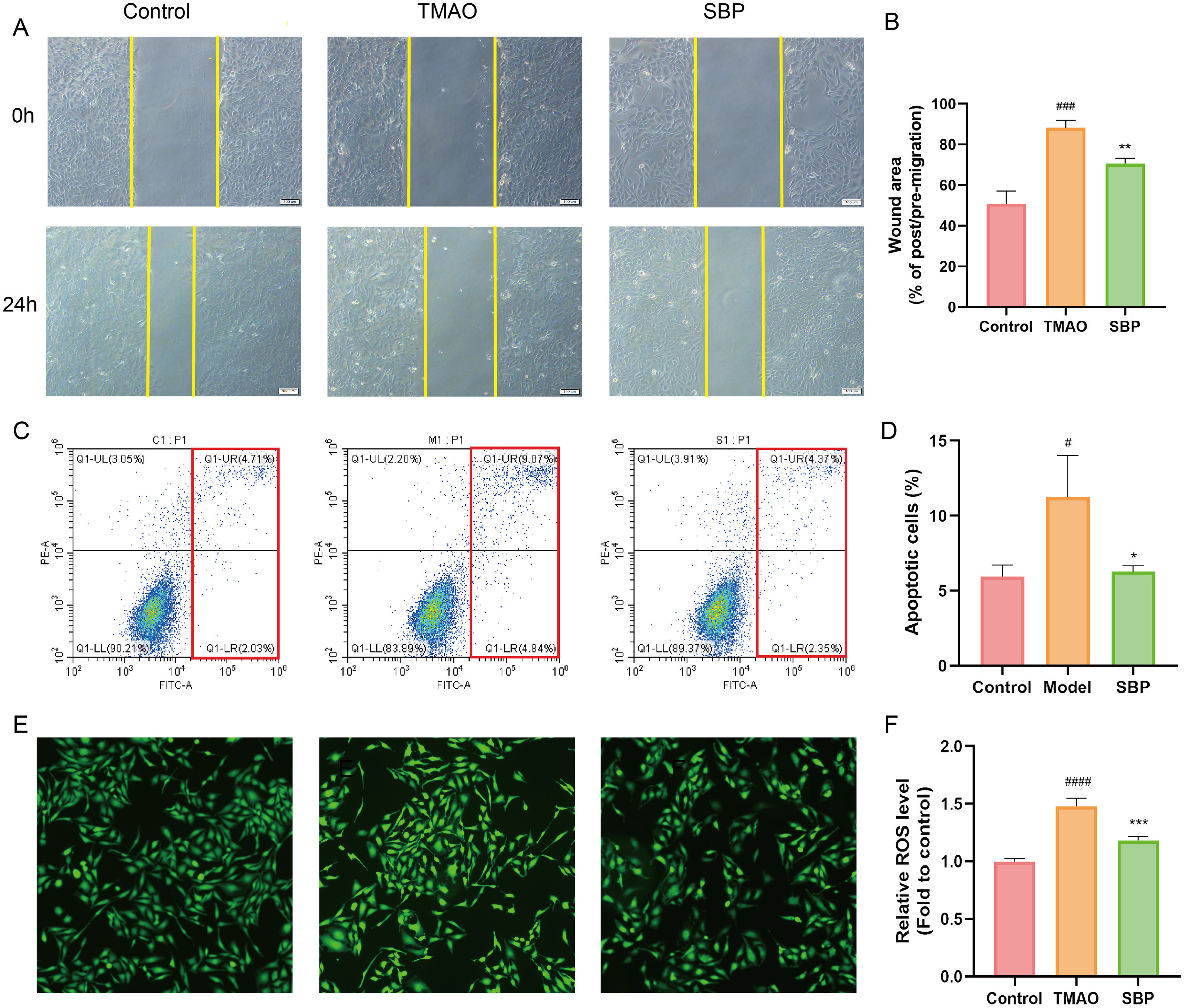
图6
5、SBP可减轻体内和体外的内皮功能障碍
内皮功能障碍已被确定为诱发动脉粥样硬化的起始因素之一,而VCAM-1和ICAM-1的表达对于内皮功能障碍的调节至关重。研究SBP对内皮损伤调控的体内影响是通过免疫组化实验进行的。在模型中,VCAM-1和ICAM-1的水平显著升高。而SBP可抑制它们的表达(图7A-D)。在体外,发现TMAO增加了HUVEC中ICAM-1和VCAM-1的表达,相反,SBP组的ICAM-1和VCAM-1表达明显降低,这表明SBP在体外参与了对TMAO诱导的内皮损伤的保护。此外,LOX-1也是内皮功能障碍的指标之一,观察了它在TMAO和SBP作用下是否与ICMA-1有相同的趋势。TMAO可诱导HUVEC中LOX-1的表达上调,而SBP可抑制LOX-1的表达(图7E-H)。因此,研究结果表明,SBP可降低主动脉根部和HUVEC中LOX-1、ICAM-1和VCAM-1的表达,反映了SBP通过缓解内皮功能障碍对AS具有保护作用。
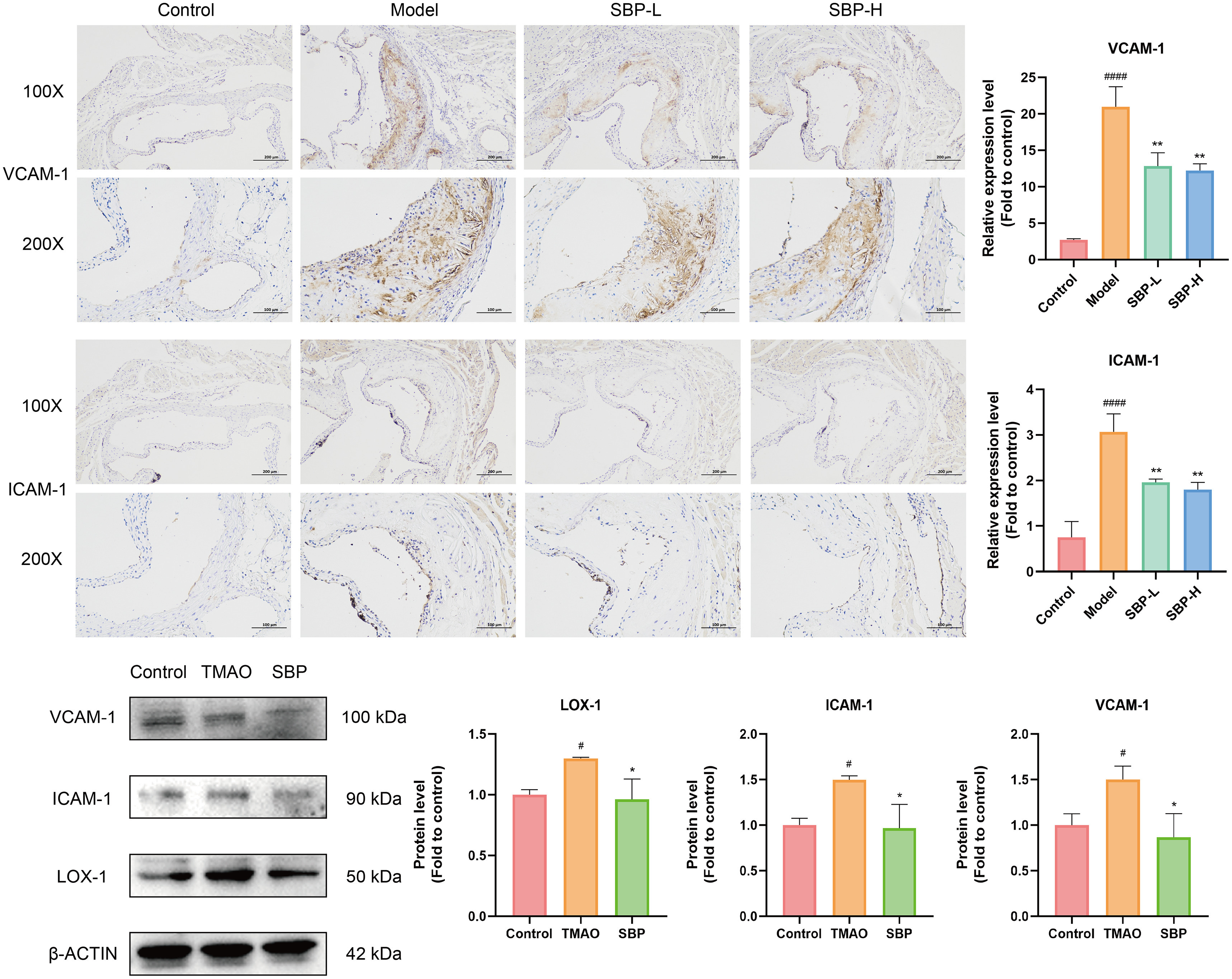
图7
6、通过减少MAPK3、AKT1和STAT3的表达,SBP可改善动脉粥样硬化的病情
通过结合初步的网络药理学和代谢组学研究,作者预测MAPK3、AKT1和STAT3是SBP参与AS调控的关键靶标;接下来试图在体内和体外验证这些结果,对MAPK3的免疫组化分析表明,模型组中MAPK3表达上调,而SBP中表达下调(图8A-B)。对各组小鼠采集的主动脉组织进行的Western印迹分析表明,SBP逆转了磷酸化(P)-MAPK3、P-AKT1和P-STAT3表达增加的趋势(图8C-F)。此外,体外实验表明,TMAO上调了HUVEC中P-MAPK3、P-AKT1和P-STAT3的表达,而SBP则降低了这些基因的表达(图8G-J)。简而言之,这些结果提供了SBP通过调节MAPK3、AKT1和STAT3缓解动脉粥样硬化的证据。

图8
7、分子对接
为了研究SBP有效成分与核心靶点之间的相互作用,进行了分子对接分析,选择了山奈酚、N-核苷酸和麦角胺作为配体,并根据配体与靶点网络的程度选择了山奈酚和麦角胺作为配体。选择MAPK3、STAT3和AKT1作为受体,它们的the best结合模式和亲和力如图9所示。根据分子对接的结果,本研究中评估的三种SBP成分能够与确定的三个靶点形成稳定的相互作用。

图9
8、酶抑制作用
为了验证分子对接的准确性,通过酶抑制实验检测了山奈酚、N-核苷酸和麦角胺对MAPK3、STAT3和AKT1的抑制作用。山奈酚、N-核苷酸和麦角胺对MAPK1的抑制率分别为(68.52±±0.40)%、(63.07±±0.45)%和(72.04±±0.07)%、图10A);对STAT3的抑制率分别为(59.84±±0.51)%、(60.84±±0.70)%和(61.84±±0.59)%(图10B)。AKT1为(63.48±±0.45)%,(66.87±±0.47)%,(74.09±±0.45)%。0.49)%(图10C)。以上结果均大于50%,其中麦角胺对AKT1的抑制作用最强,这与分子对接结果一致。总之,酶抑制实验表明,这三种化合物对AKT1的抑制作用均在50%以上(图10C)。对这三种蛋白质的抑制作用,并在体外验证了分子对接的准确性。
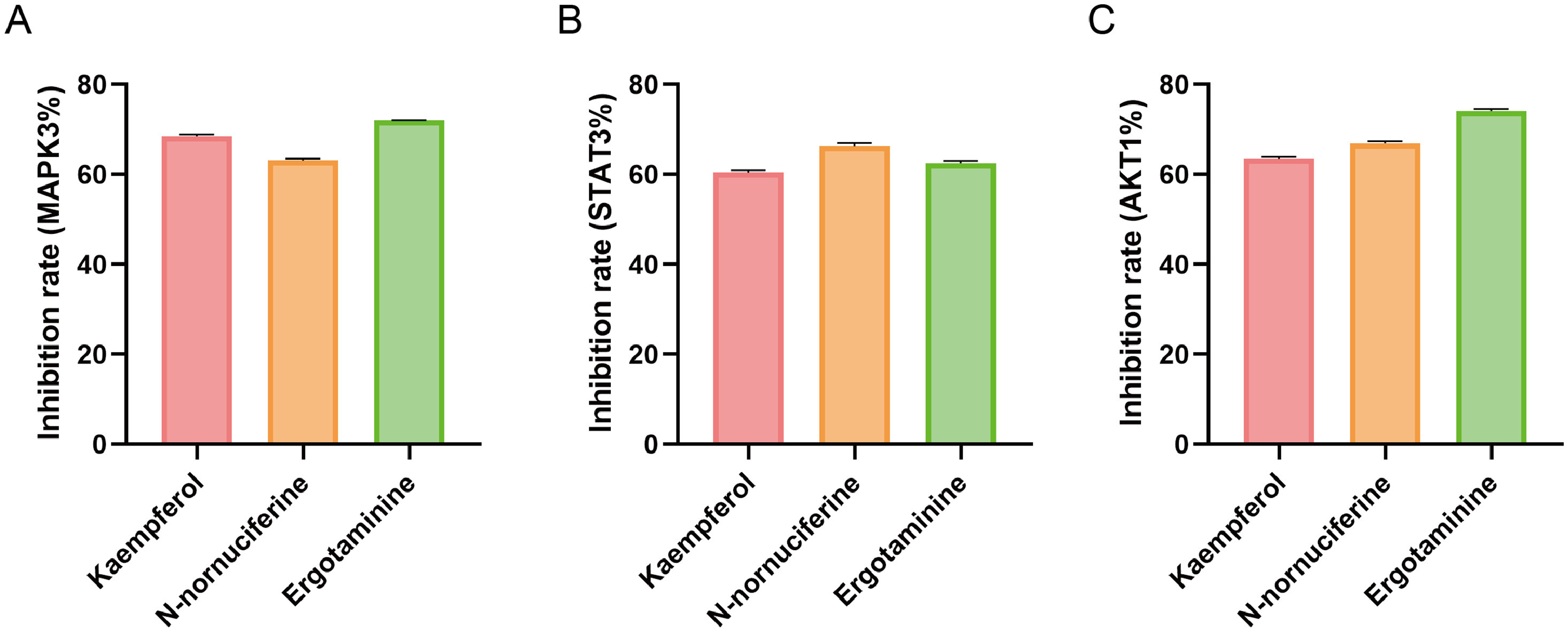
图10
总结:本文的思路很完整,网络药理学+代谢组学的综合研究,并进行了验证,为SBP通过介导肠道-心脏轴参与心血管保护提供了新的见解!傲星生物有丰富的分析方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




