网络药理学+分析对接,探索葛根在肥胖调节中的作用!!
题目:探索葛根在肥胖调节中的作用
英文名:Exploring the mechanism of Pueraria lobata (Willd.) Ohwi in the regulation of obesity
杂志:Journal Of Ethnopharmacology
影响因子:4.8/Q1
发表时间:2024年8月16日
研究背景:葛根(PR)富含黄酮类、三萜类、皂苷、多糖等化学成分。肥胖和各种慢性疾病不仅对人们的健康构成巨大威胁,而且给人们带来沉重的经济负担和医疗投入。目前研究表明,葛根具有降低血糖、改善胰岛素敏感性和抑制肥胖的作用。然而,葛根抑制肥胖的具体机制尚不清楚,通过网络药理学和实验相结合来研究葛根抗肥胖作用的研究较少。
研究思路:本研究采用网络药理学技术研究PR的治疗效果和作用机制。通过相关数据库,共筛选出6种主要化学成分和257个潜在靶点。蛋白质相互作用分析表明,AIfT1、AKR1B1、PPARG、MMP9、TNF、TP53、BAD和BCL2是核心靶点。富集分析表明,PR在预防肥胖方面的作用途径涉及癌症信号通路和PI3K-Akt信号通路,它们可能是主要的作用途径。进一步的分子对接验证表明,其核心目标物与4种化合物具有良好的结合活性:formononectin、purerin、7,8,4,-trihydroxide和大豆黄素。利用超高效液相色谱-质谱(UPLC-MS)技术检测并确认了这些主要化合物。细胞实验结果表明,葛根素以浓度依赖性方式抑制细胞增殖和分化,显著促进细胞凋亡并影响细胞迁移。动物实验表明,葛根素能减少小鼠的食物摄入量和体重增加。研究发现,葛根素能上调高密度脂蛋白(HDL),下调总胆固醇(TC)、总胆固醇(TG)和低密度脂蛋白(LDL)等血液生化指标。Western印迹结果表明,葛根素能显著抑制AKT1、AKR1B1、MMP9、TNF、TP53、BCL2、PPARG ,并在细胞和动物水平上显著增加BAD蛋白的表达。

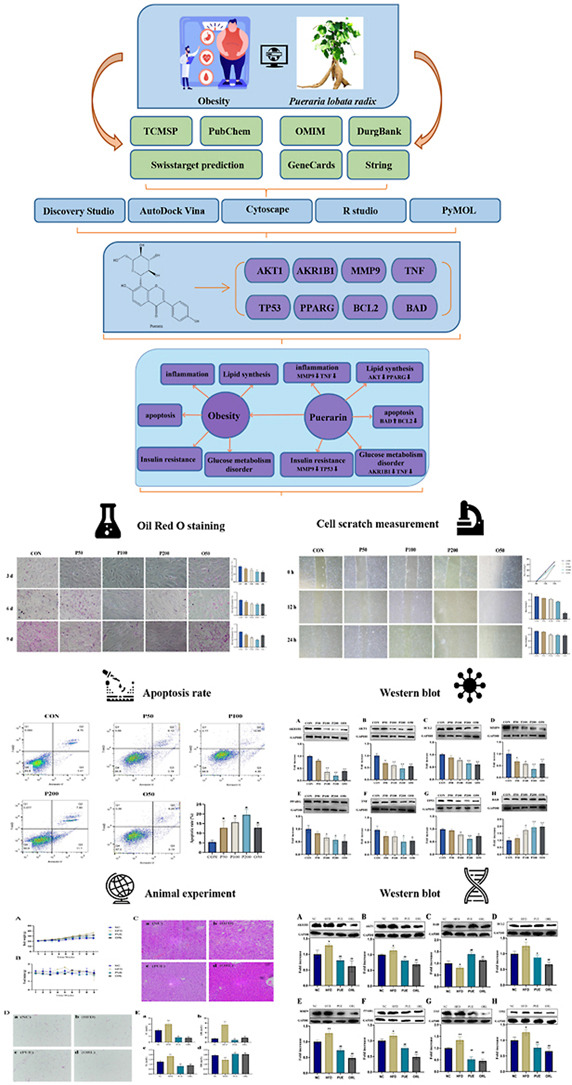
图1
研究结果:
1、PR活性成分的筛选和靶点信息分析
通过TCMSP数据库搜索 PR 的有效成分和相应的关键靶点信息。筛选出6种活性化合物:谷氨酰葡萄糖、甲醛素、β-谷甾醇、3'-甲氧基黄苷元、purerin和7,8,4'-三氢氧化物异黄酮。
2、预测潜在作用靶点,构建抗肥胖PR有效成分靶点网络
通过SwissTarget预测平台,得到了431个作用靶点。从GeneCards等数据库中共检索并整合了1521个肥胖症靶点。PR的活性成分和肥胖症共有靶点257个(图2A)。利用Cytoscape3.7.2软件进行可视化,然后得到PR、有效成分和目标的网络图(图2B)。
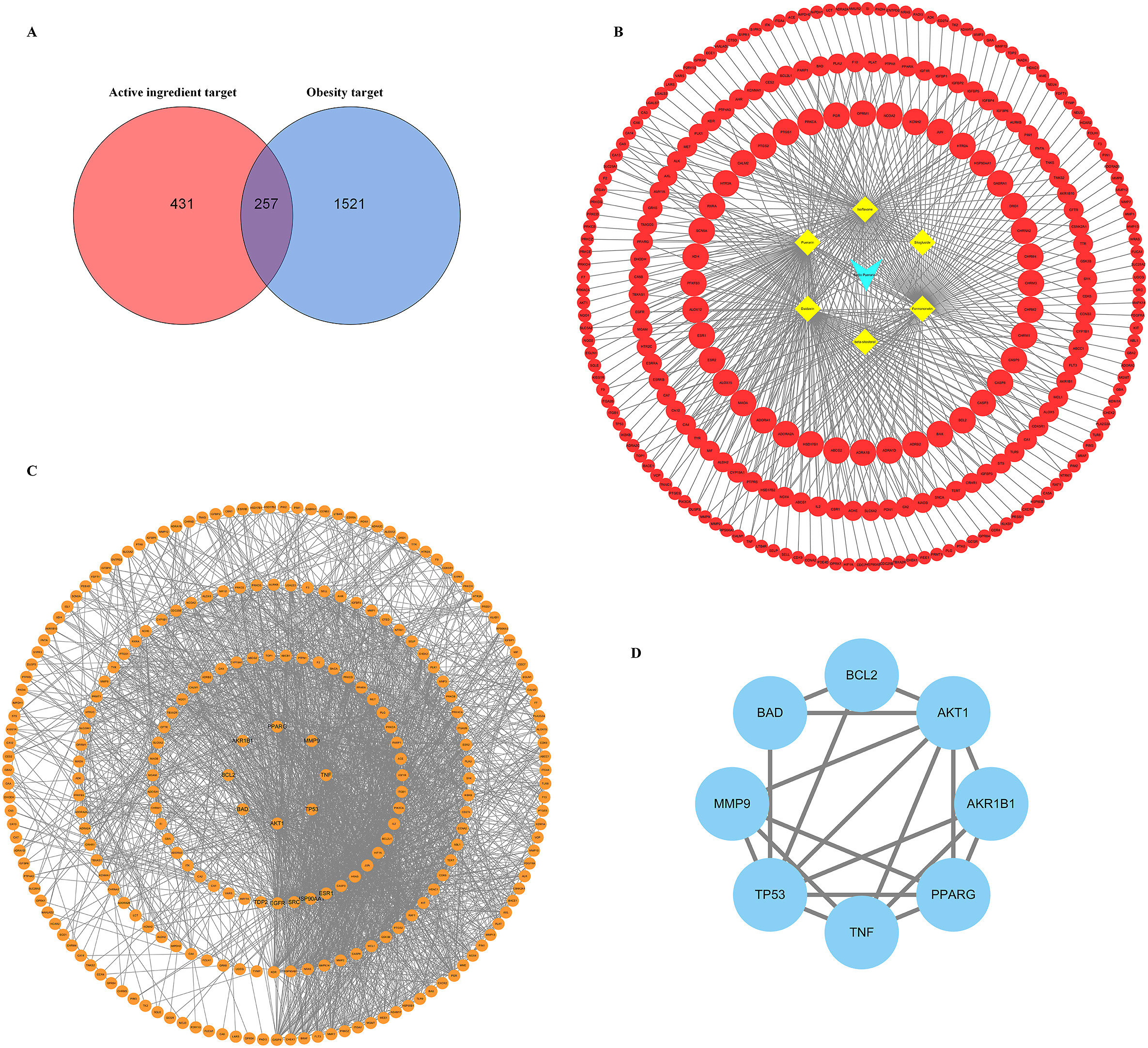
图2
3、PPI网络构建和分析
将257个常见靶标上传到STRING,并使用Cytoscape3.7.2软件对靶标蛋白进行分析,得到PPI(图2C)。其中有8个靶标超过了平均度值,推测这8个靶点是肥胖症PR的主要靶点。从这8个靶点可以看出,许多物质,如转录因子、信号分子、受体、蛋白质(转运载体蛋白)和酶(激酶、转移酶、蛋白酶)都参与了肥胖症的预防和治疗。其中,AItT1、AItR1B1、PPARG、MMP9、TNF、TP53、BAD和BCL2的节点度值排名前8位。这些靶点可能是肥胖症治疗的主要靶点。然后使用Cytoscape3.7.2软件对核心靶蛋白进行分析,得到前8个蛋白的PPI网络(图2D)。
4、GO和KEGG富集分析
GO富集分析结果表明,BP主要参与PR的抗肥胖靶标,包括信号转导、G蛋白偶联受体信号通路、RNA聚合酶II启动子转录正调控等。CC主要分布在质膜、细胞质、胞浆等部位。CC主要参与蛋白质结合、ATP结合、同种蛋白结合等(图3A)。
KEGG通路分析的结果表明,PR 治疗肥胖的靶点主要集中在癌症中的通路、EGFR酪氨酸激酶抑制剂耐药、前列腺癌、氮代谢、脂质和动脉粥样硬化、雌激素信号通路、内分泌抵抗等通路(图3B),一些关键靶基因分别与肿瘤信号通路(图3C)和PI3K-AKT信号通路(图3D)相关,并覆盖在肥胖的调控中。
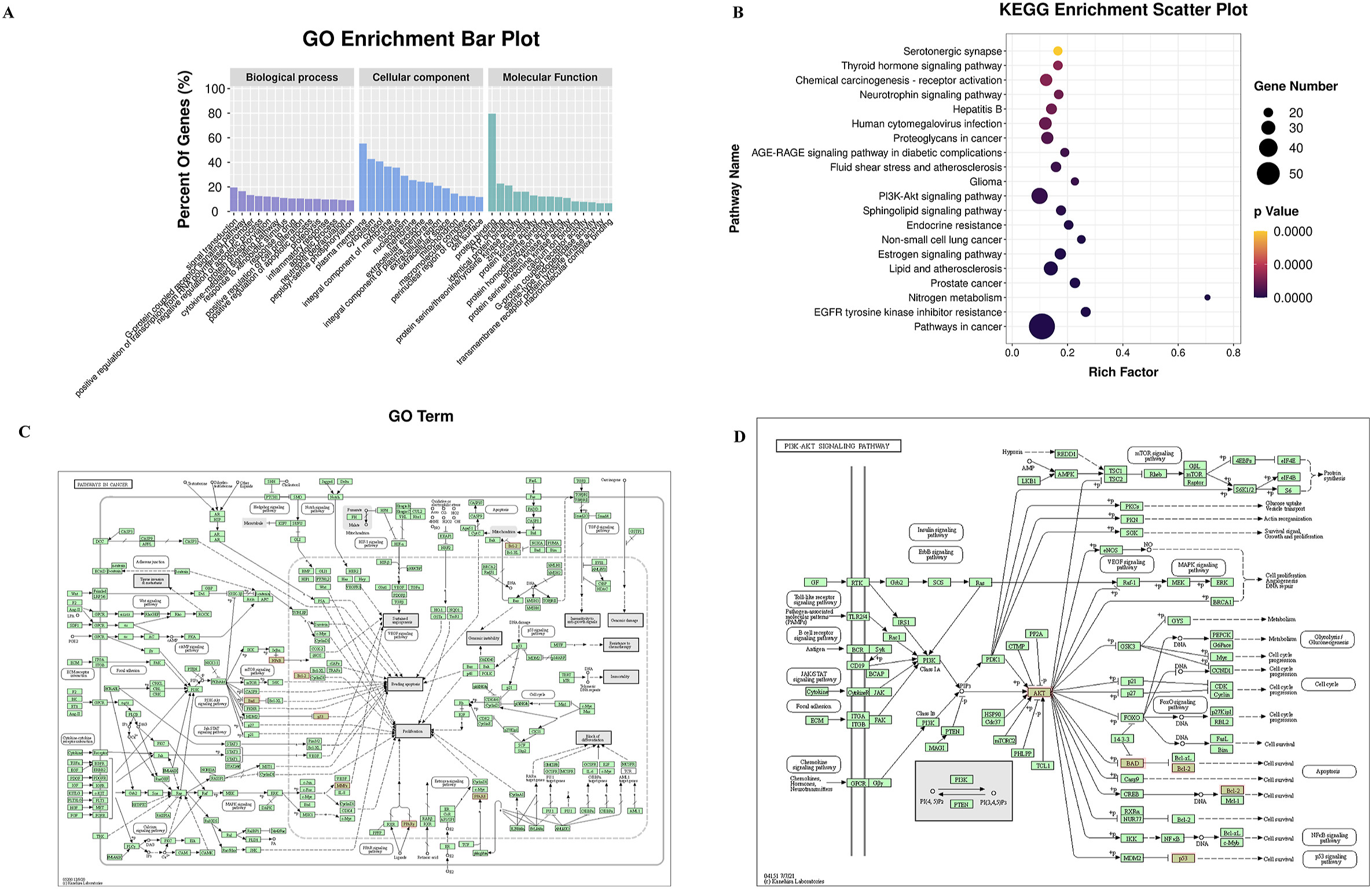

图3
5、分子对接验证结果
图4显示了6个化合物与肥胖症核心靶标的分子对接模式。对接结果显示,purerin 与 AKT1 蛋白的氨基酸残基 ARG-25 、 SER-56 和 GLU-9 形成氢键 (图4A);Daidzein与BAD蛋白的氨基酸残基ARG-55、SER-22和SER-29形成氢键(图4B);ALA-113和BAD蛋白的SER-47形成氢键(图4C);Purerin与BAD蛋白的氨基酸残基SER-22和ASN-162形成氢键(图4D);Daidzein与AItR1BI蛋白形成疏水作用(图4E);Formononetin与BAD蛋白的氨基酸残基GLN-183形成氢键(图4F)。7,8,4′-疏水性异黄酮与AKR1B1蛋白相互作用(图4G);Purerin与AKR1B1蛋白的氨基酸残基PRO-261和GLU-271形成氢键(图4H);黄豆苷元和BCL-2蛋白之间形成疏水相互作用(图4I);Purerin与BCL-2蛋白HIS-143、GLU-113和SER-49的氨基酸残基形成氢键(图4J);Purerin与TP53蛋白的氨基酸残基LYS-51、ASN-37和SER-18形成氢键(图4K);Formononetin与MMP-9蛋白的氨基酸残基SER-32形成氢键(图4L);葛根素与MMP-9蛋白的氨基酸残基ARG-17和ARG-22形成氢键(图4M);黄豆苷元与PPARG蛋白的氨基酸残基GLU-343形成氢键(图4N);7,8,4′-三羟基异黄酮与PPARG蛋白的GLY-346和ARG-280形成氢键(图4O);Purerin与PPARG蛋白的氨基酸残基SER-342、GLU-343和PHE-282形成氢键(图4P);黄豆苷元和TNF蛋白之间的疏水相互作用(图4Q);Formononetin与TNF蛋白形成疏水相互作用(图4R);葛根素和TNF蛋白形成疏水相互作用(图4S)。


图4
基于PPI网络,选择了度数前8名的核心靶基因与葛根素进行分子对接。TNF的LibDock评分为108.676(图5a),AKT1的LibDock评分为106.146(图5B),AKR1B1的评分为93.0223(图5C),BAD的评分为79.2118(图5D),BCL2的评分为78.982(图5E),MMP9的评分为105.4866(图5F),PPARG的评分为79.2118(图5 F)G)的对接评分为109.9212,与TP53结合的LibDock评分为106.189(图5H),葛根素与肥胖相关靶点的结合相对较好。
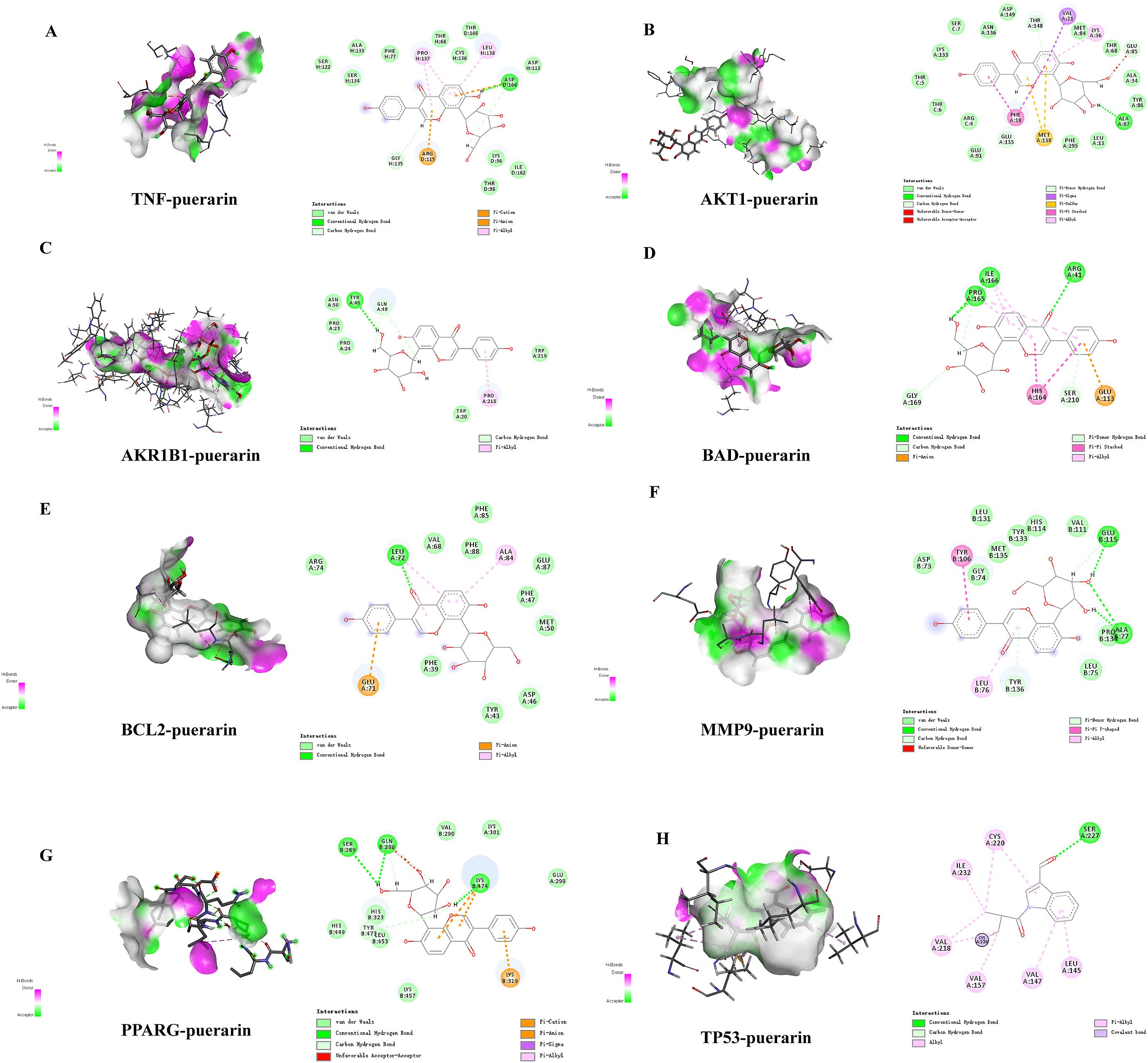
图5
6、1H-NMR,13C-NMR,UPLC-MS和GC-MS结果
图中显示了正离子模式(图6A)和负离子模式(图6B)下 PR 样品的典型总离子色谱图。共有37种化合物。通过分析UPLC-MS和GC-MS数据,确定了上述源自 PR 的6个成分。
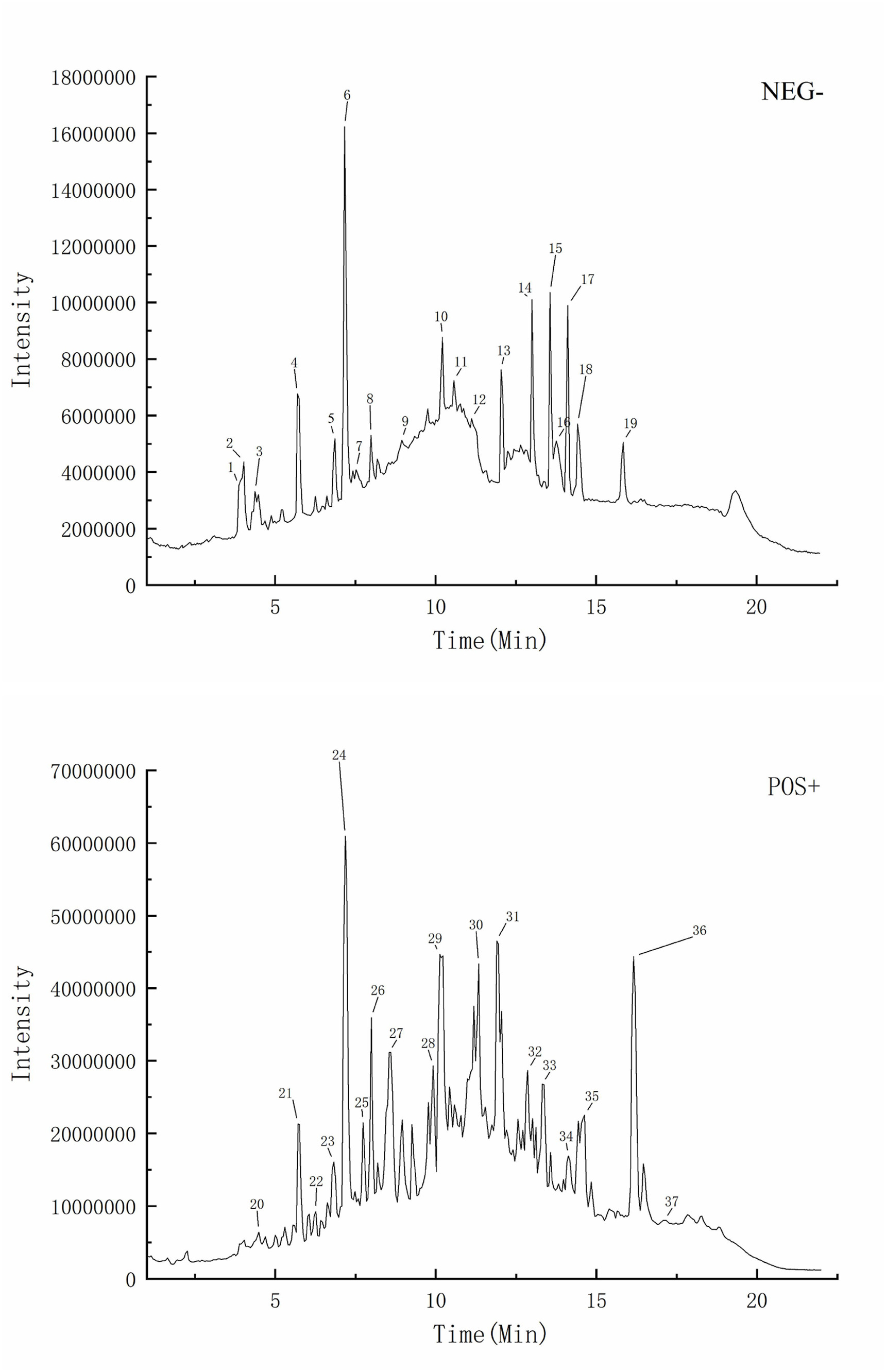
图6
7、基于3T3-L1脂肪细胞的体外实验验证结果
7.1、葛根素对3T3-LI细胞活力的影响
图7A显示了4种活性PR化合物的二维结构图。图7B为PP中LibDock得分highest的化合物(葛根素)的三维结构图。为了研究葛根素对3T3-LI细胞活性的影响,本研究比较了加入或不加入不同浓度的葛根素(50、100、200、400、800和1000mg/L)和不同浓度的奥利司他阳性药物(50和100mg/L)后的对照组。发现葛根素以剂量依赖的方式降低了3T3-LI前脂肪细胞的活性,这与阳性药物的趋势一致(图7C)。
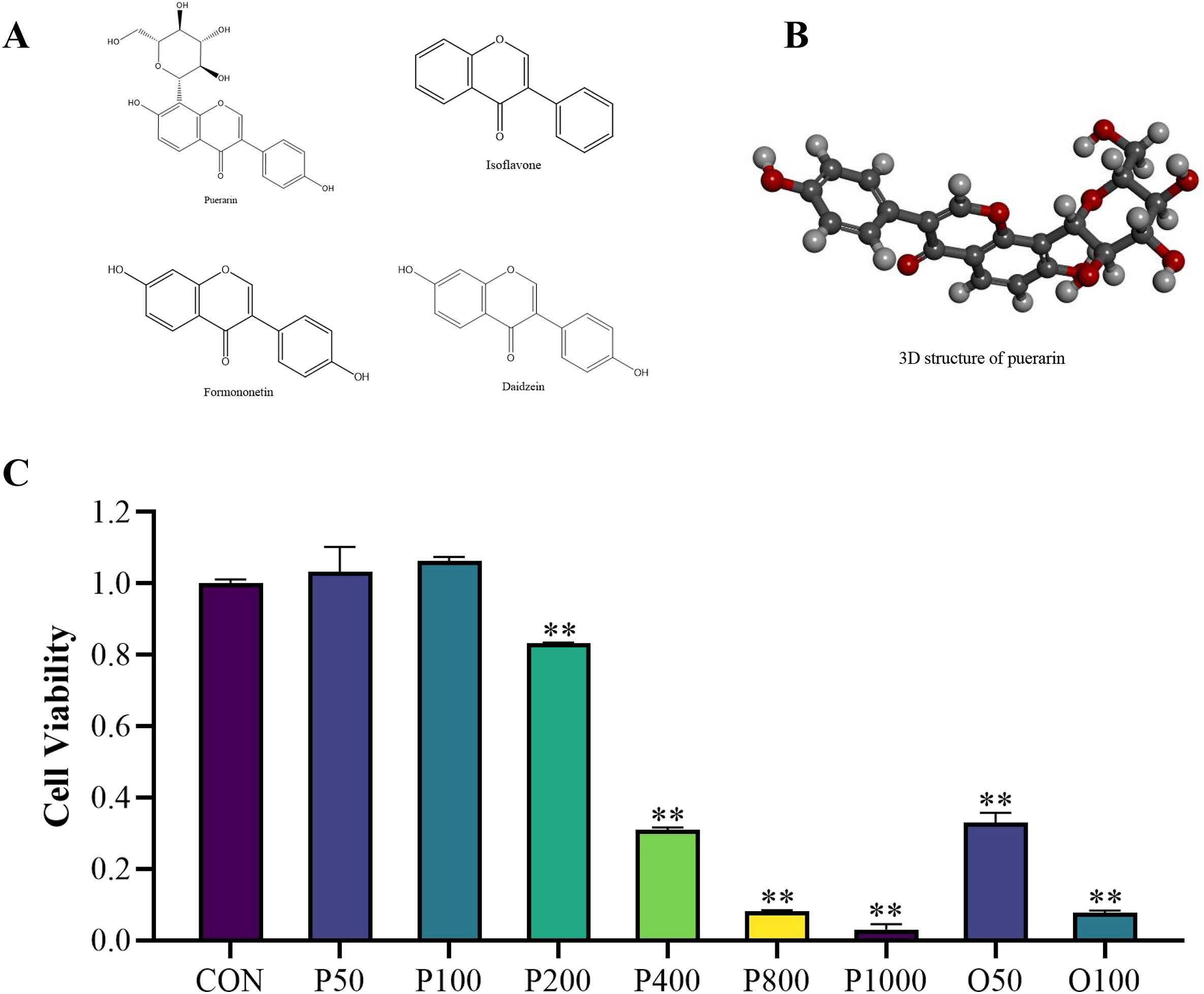

图7
7.2、葛根素对3T3-LI前脂肪细胞划痕生长率的影
为探讨葛根素对3T3-LI细胞迁移率的影响,通过细胞划痕水平验证葛根素对细胞划痕愈合程度的影响,并对干预后12、24h分别添加或不添加不同浓度葛根素(50、100、200mgJL)和50mg/L奥利司他阳性药物的划痕伤口愈合程度进行统计(图8)。药物治疗12h后,葛根素50、100和200mgJL治疗组的划痕愈合率分别为34.82%、33.88%和26.93%,阳性药物组的划痕愈合率为24.47%。24小时后,50、100和200mgJL治疗组葛根素的划痕愈合率分别为66.23%、58.74%和51.63%,阳性药物组的划痕愈合率为56.31%。结果表明,葛根素对细胞迁移有一定的抑制作用,其剂量依赖性与阳性药物组相同。


图8
7.3、葛根素对3T3-LI前脂肪细胞的细胞凋亡结果
通过检测葛根素对细胞凋亡的影响,验证了葛根素对3T3-LI细胞活力的影响(图9)。与对照组相比,不同浓度(50、100和200mg/L)的葛根素和50mg/L奥利司他阳性药物的细胞凋亡率分别为12.31%、14.30%和19.00%。随着剂量的增加,葛根素对细胞凋亡的促进作用相同,且促进细胞凋亡的趋势呈上升趋势,说明葛根素能促进细胞凋亡。

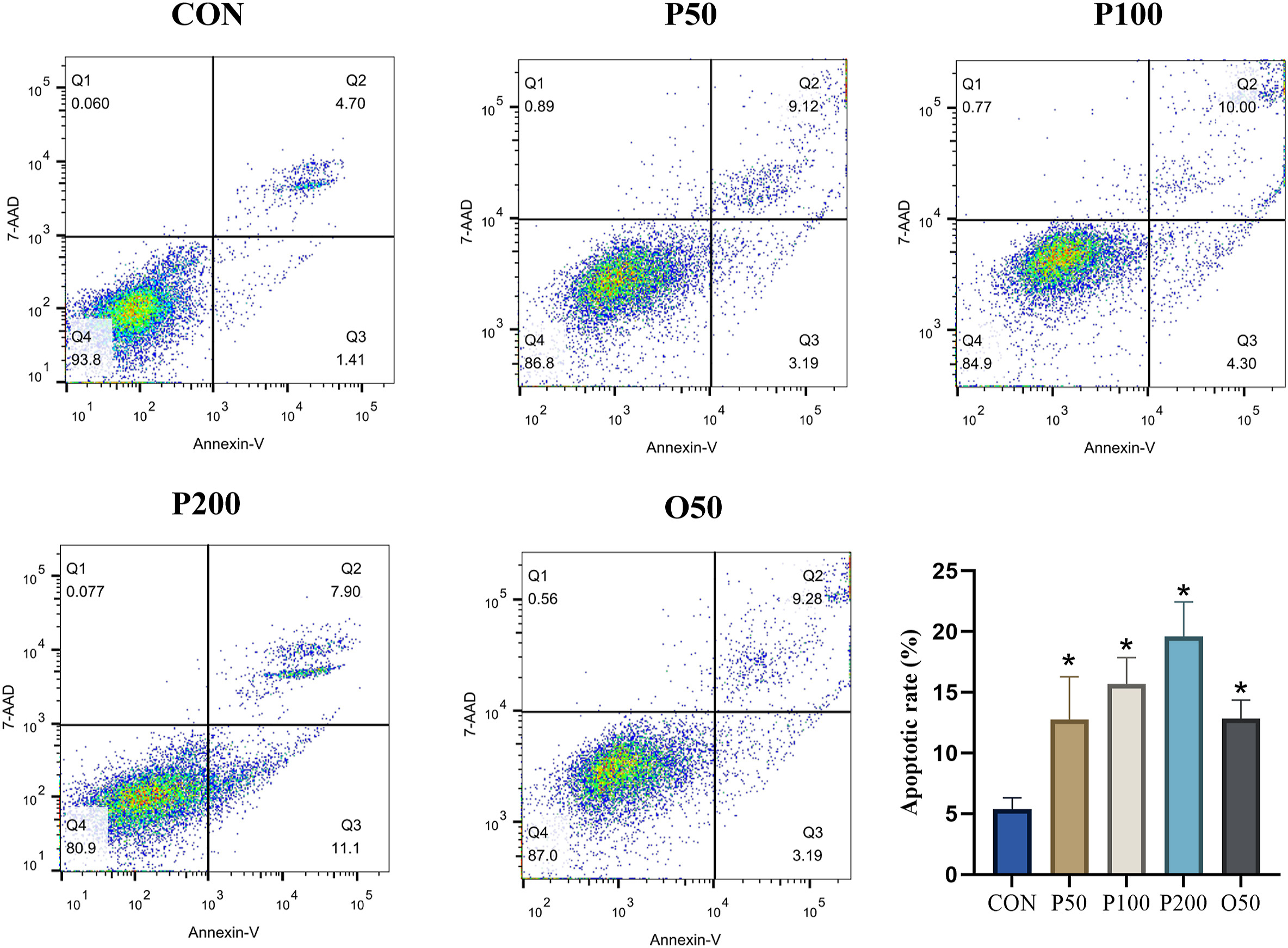
图9
7.4、葛根素对3T3-LI前脂肪细胞的油红O染色结果
为了确定葛根素是否具有抑制成脂分化的作用,本研究对添加或不添加不同浓度(50、100、200mgJL)葛根素的细胞进行了油红O染色,并设立了药物干预阳性组。与完全分化的脂肪细胞相比,葛根素剂量依赖性地抑制了3T3-LI细胞在第3、6和9天的脂滴生成(图10)。第9天的抑制效果更明显,且抑制效果优于阳性药物。因此,葛根素可减少3T3-LI细胞脂肪分化过程中的脂质积累。
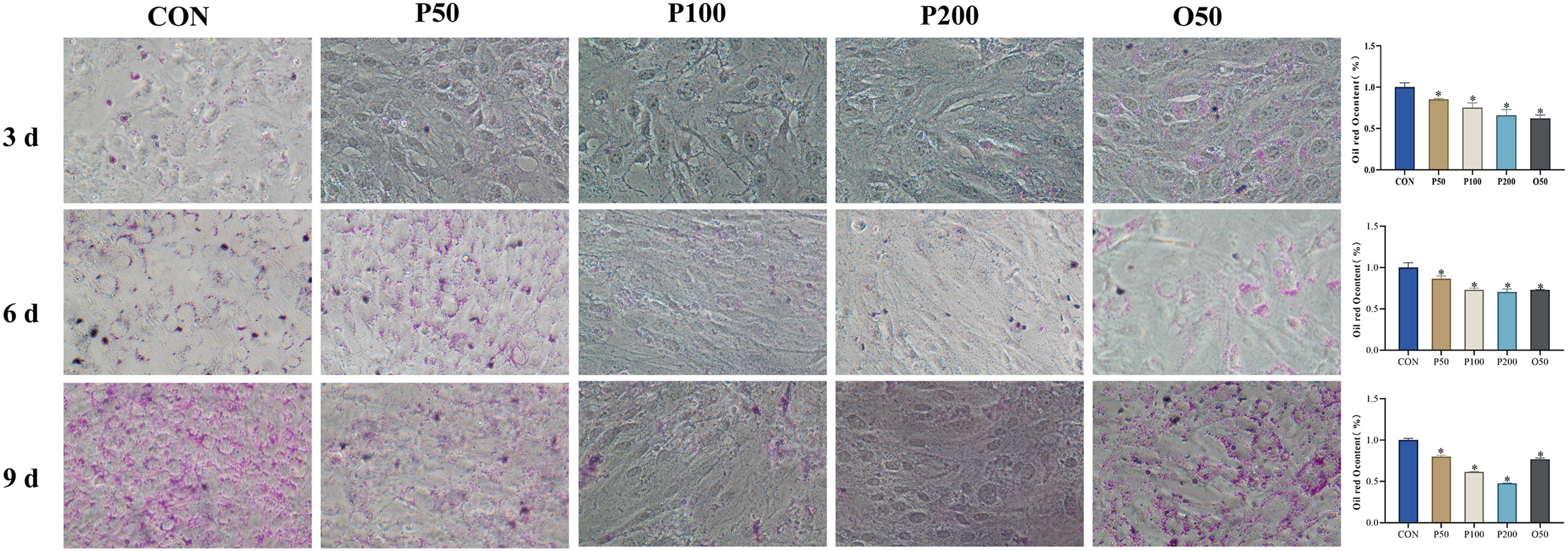

图10
7.5、葛根素对相关蛋白表达量的影响
与对照组相比,模型组AKR1B1(图11A)、AKT1(图11B)、BCL2(图11C)、MMP9(图11D)、PPARG(图11E)、TNF(图11F)和TP53(图11G)蛋白的表达水平显著升高(P<0.05),而BAD的表达水平(图11H)蛋白显著降低(P <0.05)。与模型组相比,给药组AKT1、AKR1B1、PPARG、MMP9、TNF、TP53和BCL2蛋白表达水平显著降低(P <0.05),而BAD蛋白表达水平显著升高(P <0.05)。


图11
8、体内食物摄入量和体重的结果
在研究结束时(第9周),与其他组相比,实验组之间的食物摄入量有所减少,如图 12B.NC:第1周20.849,第9周26.065,增加25.02%HFD:第1周20.609,第9周36.134,增加75.33%PUE:第1周20.456,第9周27.166,增加32.80%ORL:第1周20.905,第9周31.647,增加51.38%。所有小鼠的体重变化如图 12A所示。NC组小鼠体重增加了25.02%,而高脂饮食喂养的动物体重增加了75.33%,显著高于NC组。然而,PUE组小鼠的体重仅比初始体重增加了32.80%,显著低于HFD组。这表明PUE干预可以降低体重增加的速度。
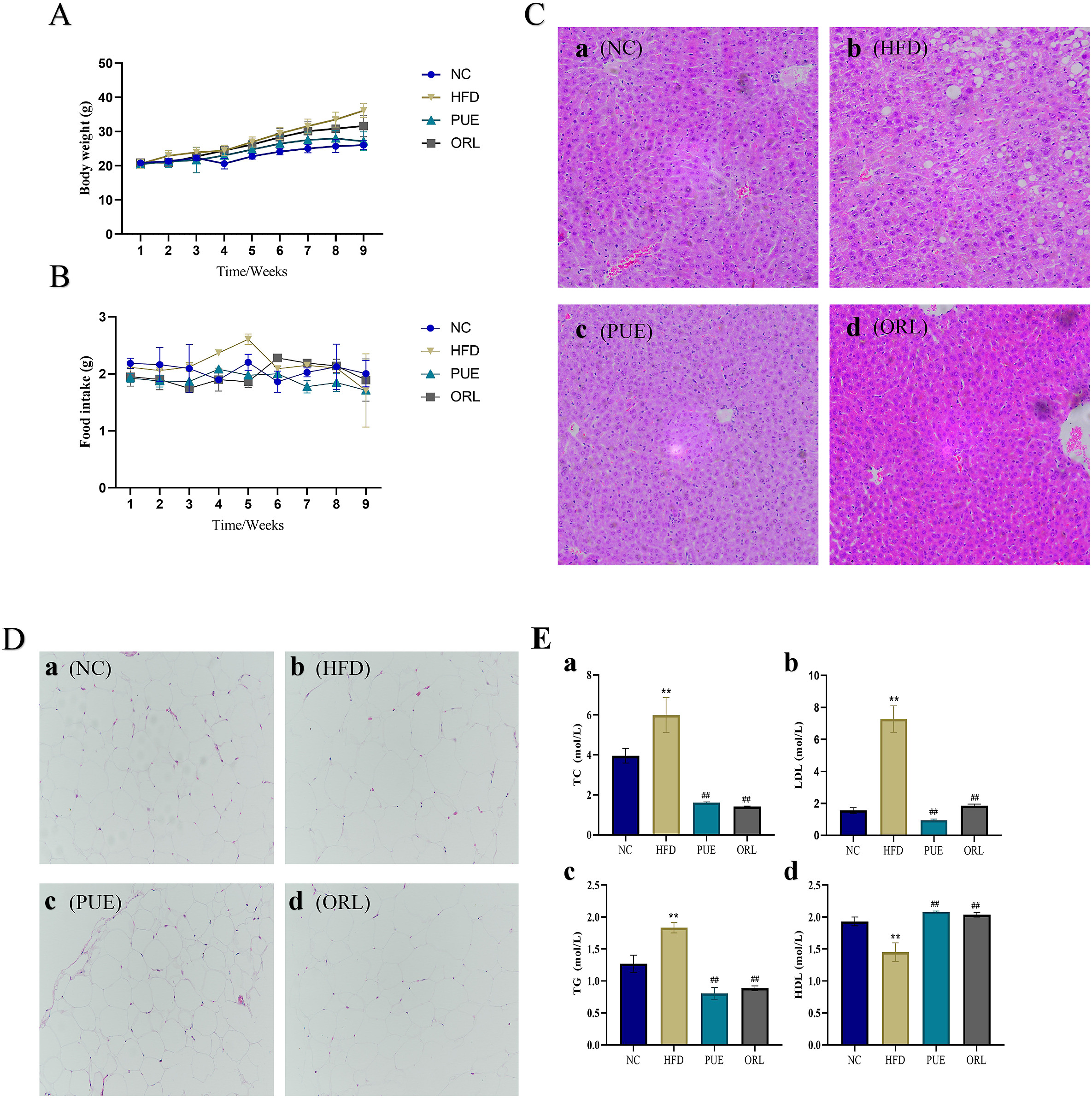
图12
9、体内苏木精和伊红染色结果
分别对脂肪组织和肝组织进行了苏木精和伊红(H&E)染色。脂肪组织的染色结果表明,补充葛根素可以缩小脂肪细胞的体积。图12D显示,葛根素处理组小鼠的细胞体积与对照组相同,而高脂饮食组小鼠的细胞体积均与对照组相同。此外,葛根素处理还减少了大中型脂肪细胞的数量。同时,肝脏的H&E染色(图12C)显示,喂食高脂饮食的小鼠肝脏中有脂滴,而葛根素能有效缓解酒精和高脂饮食诱导的脂质积累。H&E染色显示肝组织结构严重异常,空泡化严重。肝脏组织中一些肝细胞排列稀疏,少数肝细胞水肿。一些炎性细胞也有浸润。PUE干预后,这些症状明显缓解。
10、体内生化分析结果
体内生化分析结果如图 12E所示,HFD组血清甘油三酯(TG)和总胆固醇(TC)水平显著高于NC组。与HFD组相比,PUE组血脂水平显著降低。从血清总甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)和高密度脂蛋白胆固醇(HDL-C)4项血脂指标观察葛根素的调节功能,差异显著,呈改善趋势。
11、体内Western印迹检测结果
Westernblot结果显示,如图13 所示,与NC组相比,HFD显著上调PPARG、BCL2、TNF、AKT、TP53、MMP9、AKR1B1,显著下调BAD。与HFD组相比,PUE组显著改善PPARG、BCL2、TNF、AKT、TP53、MMP9、AKR1B1的上调和BAD的下调。
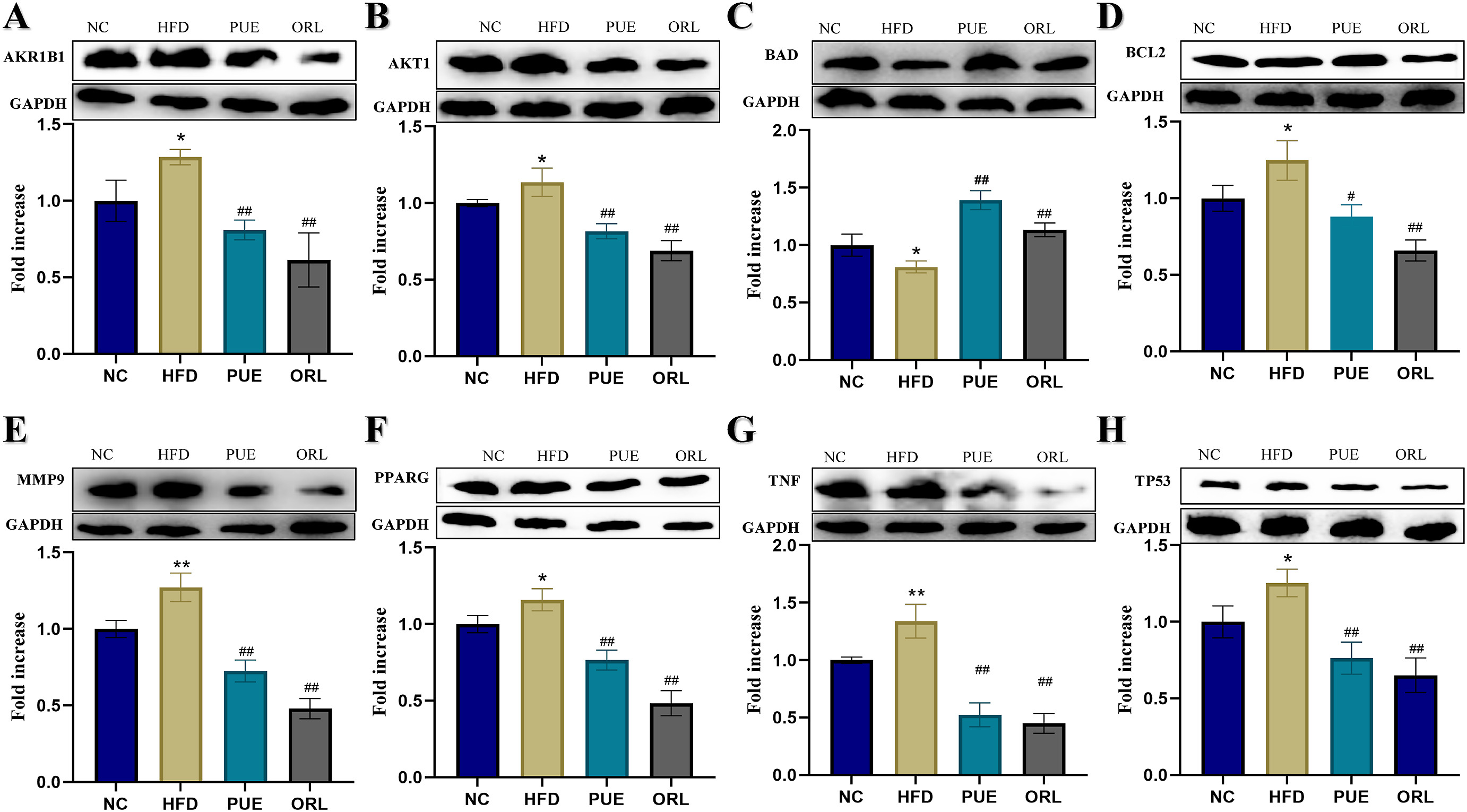

图13
总结:本研究采用网络药理学+分析对接的方法,预测了其有效成分及其治疗肥胖症的作用机制,为进一步研究提供了理论依据!傲星生物有丰富的分析方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




