网络药理学、分子对接和实验验证,一举斩获6分佳绩!
题目:网络药理学、分子对接和实验验证探索诺米林对三阴性乳腺癌的治疗效果和潜在机制
英文名:Integrating network pharmacology, molecular docking and experimental verification to explore the therapeutic effect and potential mechanism of nomilin against triple-negative breast cancer
杂志:Molecular Medicine
影响因子:6
发表时间:2024年9月28日
研究背景:诺米林是一种柠檬类化合物,具有抗炎、抗肥胖、抗氧化、抗破骨细胞生成、神经保护、免疫调节和解毒等多种生物效应,但其在三阴性乳腺癌(TNBC)中的作用仍不清楚。本研究旨在揭示诺米林对TNBC的潜在治疗作用,并阐明其作用的具体机制。
研究思路:采用加权基因共表达网络分析(WGCNA)、差异表达分析和GeneCards数据库来确定TNBC的潜在靶点。同时,利用Swiss Target Prediction、ChEMBL和STITCH数据库确定了诺米林的潜在靶点。通过蛋白-蛋白相互作用(PPI)网络分析、分子对接和富集分析,预测了诺米林对TNBC的核心靶点和作用机制。最后,通过实验证实了网络药理学的结果。
研究结果:
1、获得诺米林治疗TNBC的潜在靶点
对TNBC队列样本进行了差异表达分析,共获得9308个DEGs。WGCNA分析确定了TNBC肿瘤特征的特定模块,其中MEturquoise模块与TNBC肿瘤表型的相关性highest,从该模块中提取了12524个基因(图1A)。然后,从GeneCards数据库中筛选出3472个与TNBC相关的潜在靶点。将三种分析方法得到的潜在靶点组合成一个维恩图(图1B),共得到17204个TNBC潜在靶点。随后,利用Swiss Target Prediction、ChEMBL和STITCH数据库,确定了301个诺米林的潜在靶标(图1C)。将301个诺米林靶点与17204个TNBC相关潜在靶点进行交叉分析,发现有221个交叉点为诺米林针对TNBC的潜在靶点(图1D)。此外,还利用Cytoscape构建了诺米林抗TNBC的药物-靶点-疾病网络。
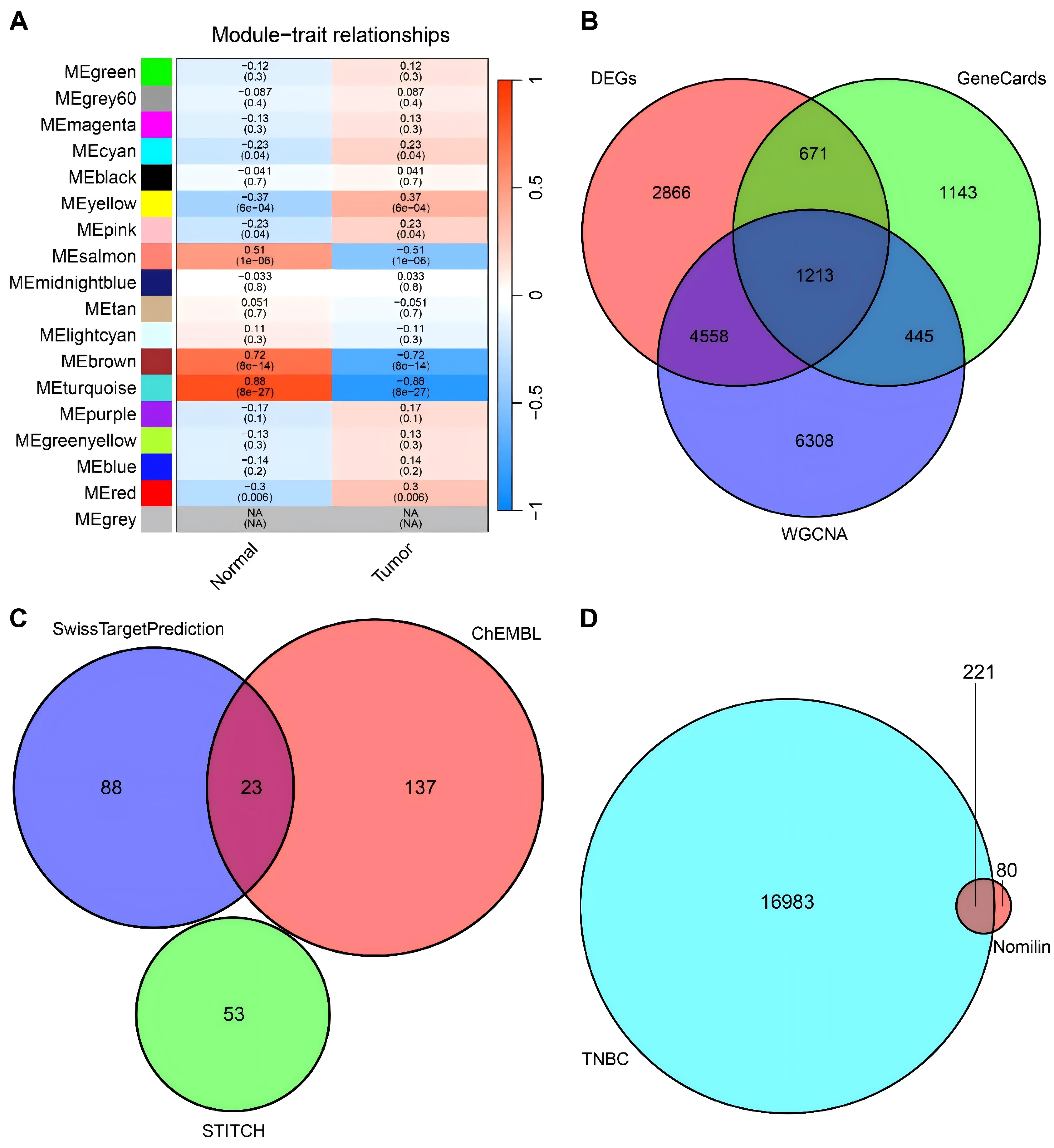
图1
2、建立PPI网络和识别核心靶点
为了确定诺米林对TNBC的主要作用,利用String数据库构建了一个由219个节点和562条边组成的PPI网络(图2A),共确定了8个核心靶标:BCL2、Cas-pase3、CyclinD1、表皮生长因子受体、HSP90AA1、KRAS、PARP1和TNF(图2B)。图2C描述了八个核心靶标与其他靶标之间的蛋白质相互作用网络。
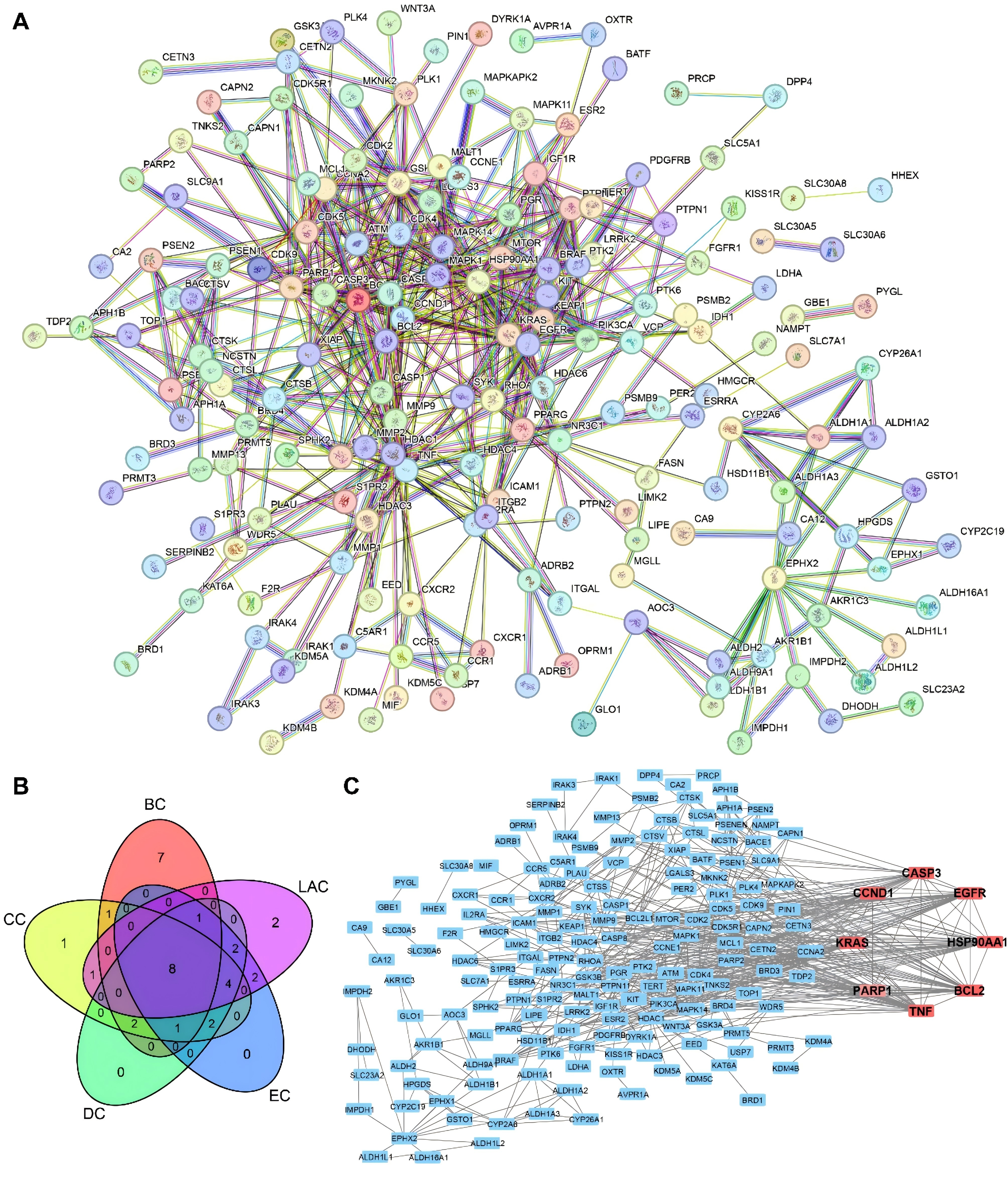

图2
3、分子对接分析和动力学模拟
通过分子对接评估诺米林与已确定的八个核心靶标之间的潜在结合。使用PyMol软件对结果进行了可视化(图3A-H)。诺米林与BCL2、Caspase3、CyclinD1、表皮生长因子受体、HSP90AA1、KRAS、PARP1和TNF的结合能分别为-6.74、-8.14、-8.29、-6.97、-8.45、-9.28、-7.67和-6.94 kcal/mol。值得注意的是,重复三次的结果一致表明,诺米林与所有八个核心靶标的结合能均低于-5 cal/mol。这表明其具有良好的结合活性。此外,作者还进行了分子动力学模拟来评估诺米林之间靶点结合的稳定性。根均方偏差(RMSD)的轨迹显示,诺米林与BCL2、CYCLIND1、EGFR、HSP90AA1、PARP1和TNF的结合始终保持一致的稳定性,这表明诺米林对这些目标具有很强的结合亲和力。
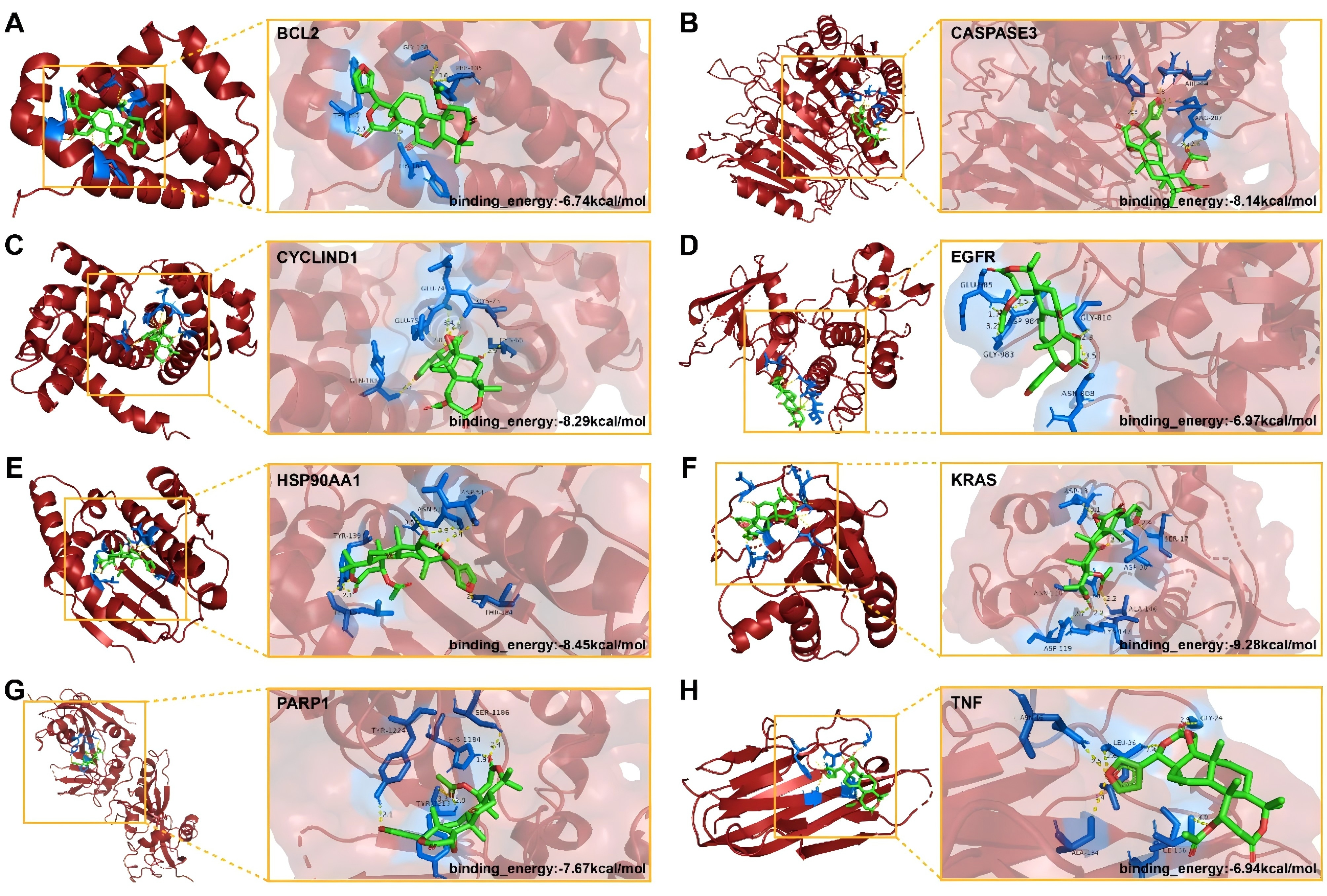
图3
4、诺米林与核心靶标的蛋白质组芯片分析
作者使用了包含约20000个人类全长蛋白质的蛋白组芯片,来评估诺米林与核心靶标的结合亲和力,并用Cy5-SA对由此产生的结合情况进行可视化检测(图4A)。图4B显示了结果的一个子集,图4C则提供了描述诺米林与其核心靶标相互作用的放大图像。结果表明,诺米林与其核心靶标之间具有很强的结合亲和力。
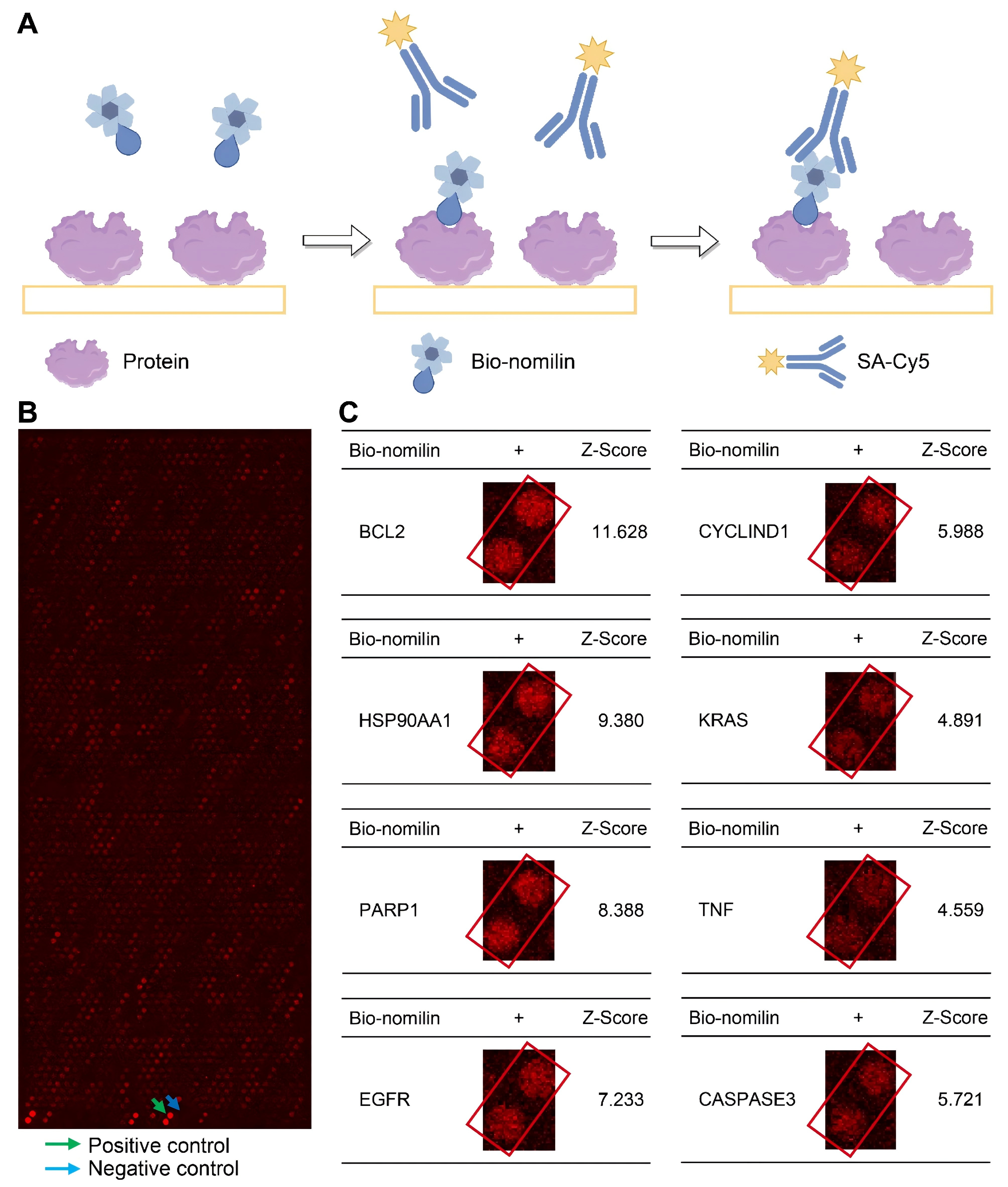

图4
5、功能富集分析
为了阐明诺米林治疗TNBC所涉及的关键生物过程,进行了GO富集分析(图5a-B),发现8个核心靶标主要与类似泛素蛋白连接酶的蛋白质结合、泛素蛋白连接酶和磷酸酶结合等反应有关。同时,对细胞成分的分析表明,与细胞核包膜、核膜和细胞下部有关的反应比较集中。此外,中频分析强调了相关靶标参与对辐射、光刺激和神经元死亡的反应。为了研究与这8个主要靶标相关的信号通路,进行了KEGG富集分析(图5C-D)。结果表明,与这些中心目标密切相关的信号通路包括结直肠癌、前列腺癌、通过受体激活的化学致癌物、癌症中的微量核糖核酸、PI3K-Akt信号通路、内分泌治疗抗药性、细胞凋亡和雌激素通路。研究结果清楚地表明了诺米林的抗肿瘤作用与这些通路之间的密切联系。其中,PI3K/Akt通路是富集基因数量最多的通路之一,它可能在介导诺米林抗肿瘤坏死细胞作用方面发挥了重要作用。
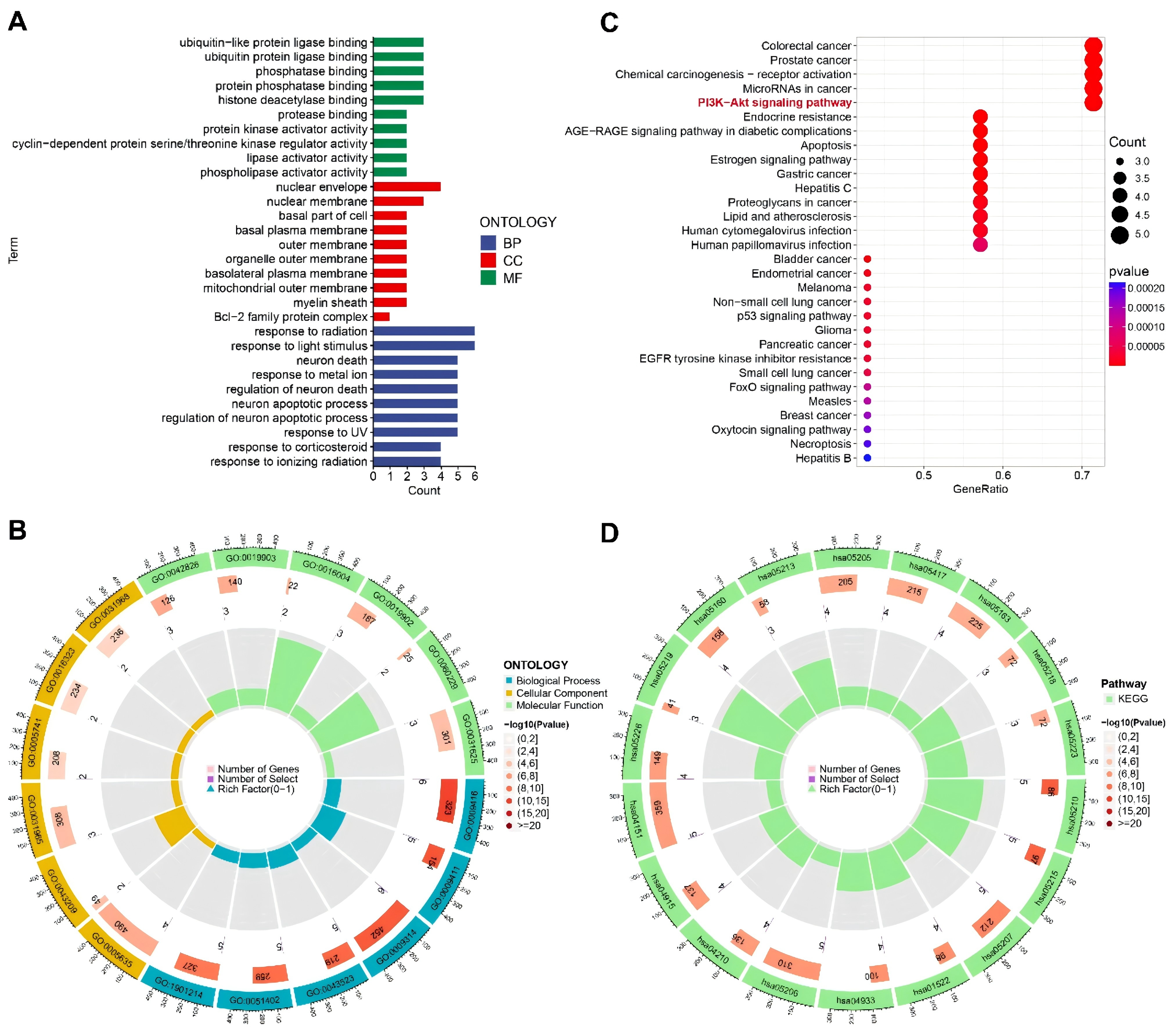
图5
6、诺米林可抑制三阴性乳腺癌细胞系(TNBCCs)的增殖
为了评估诺米林抑制TNBCCs的细胞增殖潜力,利用CCK-8测定了不同浓度的诺米林处理后TNBCCs的细胞通透性。图6A-B所示的结果表明,诺米林对TNBCCs增殖的抑制作用呈浓度依赖性。根据CCK-8的结果,选择150 μM和300 μM的浓度进行进一步的实验验证。姜黄素(80 μM)用作阳性对照。克隆形成试验表明,与对照组相比,用150 μM和300 μM的诺米林处理后,TNBCCs菌落数明显减少(图6C-E)。Western印迹分析以评估TNBC细胞中增殖细胞核抗原(PCNA)的表达。如图7F-H所示,诺米林显著抑制了TNBCCs中PCNA的表达。这些结果共同表明,诺米林可以剂量依赖性地抑制TNBCCs的增殖。
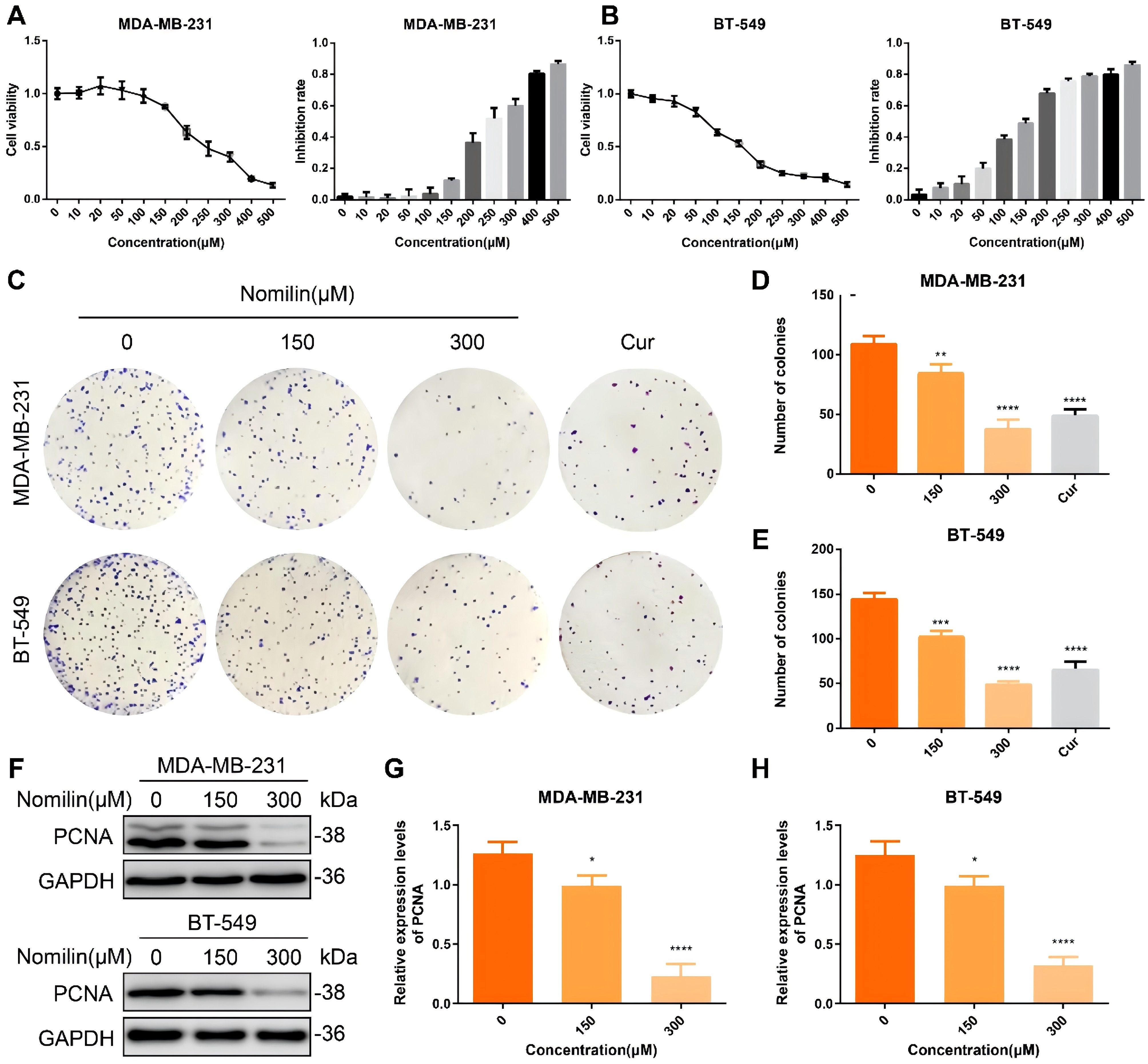
图6
7、诺米林可抑制TNBCCs迁移
作者进行了伤口愈合和Transwell试验,以研究诺米林对TNBCCs迁移的潜在抑制作用。图7A-D表明,未经处理的MDA-MB-231和BT-549细胞显示出很强的迁移能力,而诺米林处理则会显著抑制这些细胞株的迁移,而且迁移能力的强弱与浓度有关。此外,还为了观察到的诺米林对TNBC迁移的抑制作用是否与上皮-间质转化(EMT)有关,使用诺米林后评估了EMT标记蛋白的水平。图7E-H描述了WB结果,显示由于诺米林的显著作用,E-cadherin明显上调,Vimentin下调。综上所述,这些研究结果表明,诺米林可通过抑制EMT来减轻TNBCCs的迁移。

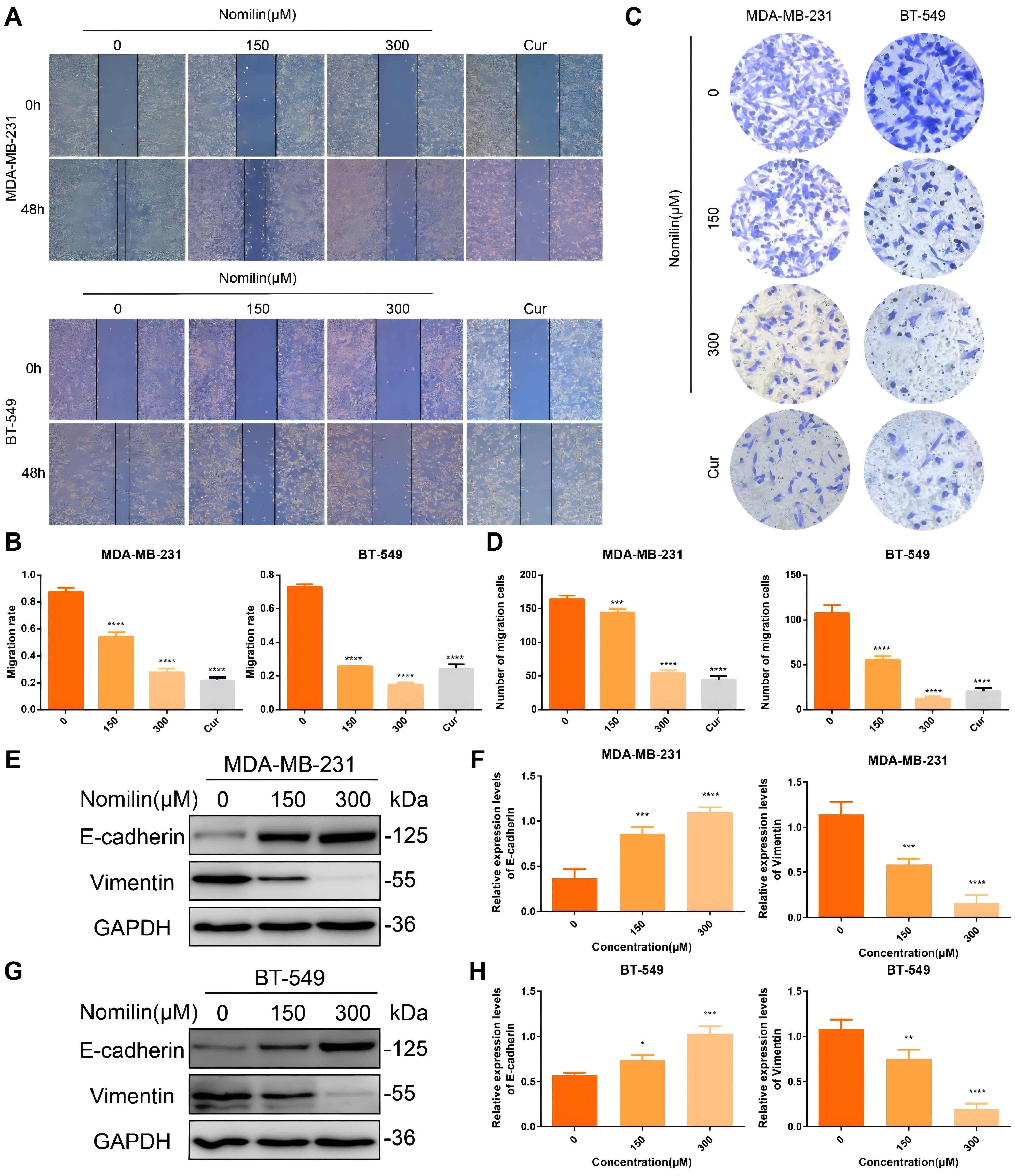 图7
图7
8、诺米林在TNBC细胞中诱导线粒体依赖性凋亡
与抗肿瘤坏死细胞作用相关的诺米林富集在细胞凋亡途径中。此外,研究还发现诺米林与细胞凋亡的关键调控因子Cas-pase3具有很强的结合活性。在此基础上,研究诺米林是否能诱导TNBCCs的细胞凋亡。图8A-B中描述的结果表明,经诺米林处理后,两种TNBCC中的细胞凋亡率均显著上升,晚期凋亡和坏死细胞的比例明显增加。凋亡的激活是由Caspase3的裂解形式对靶细胞蛋白的裂解介导的。免疫荧光分析表明,裂解的Caspase3的亮度明显增加。图8C-D,这与免疫印迹的结果一致(图8E-H)。此外,之前的网络药理学研究结果表明,BCL2也是诺米林抗击TNBC的核心靶标之一,具有很强的结合活性。WB分析结果表明,服用诺米林可抑制BCL2的水平,同时增加BAX的水平,这表明诺米林诱导的TNBCCs凋亡依赖于线粒体。
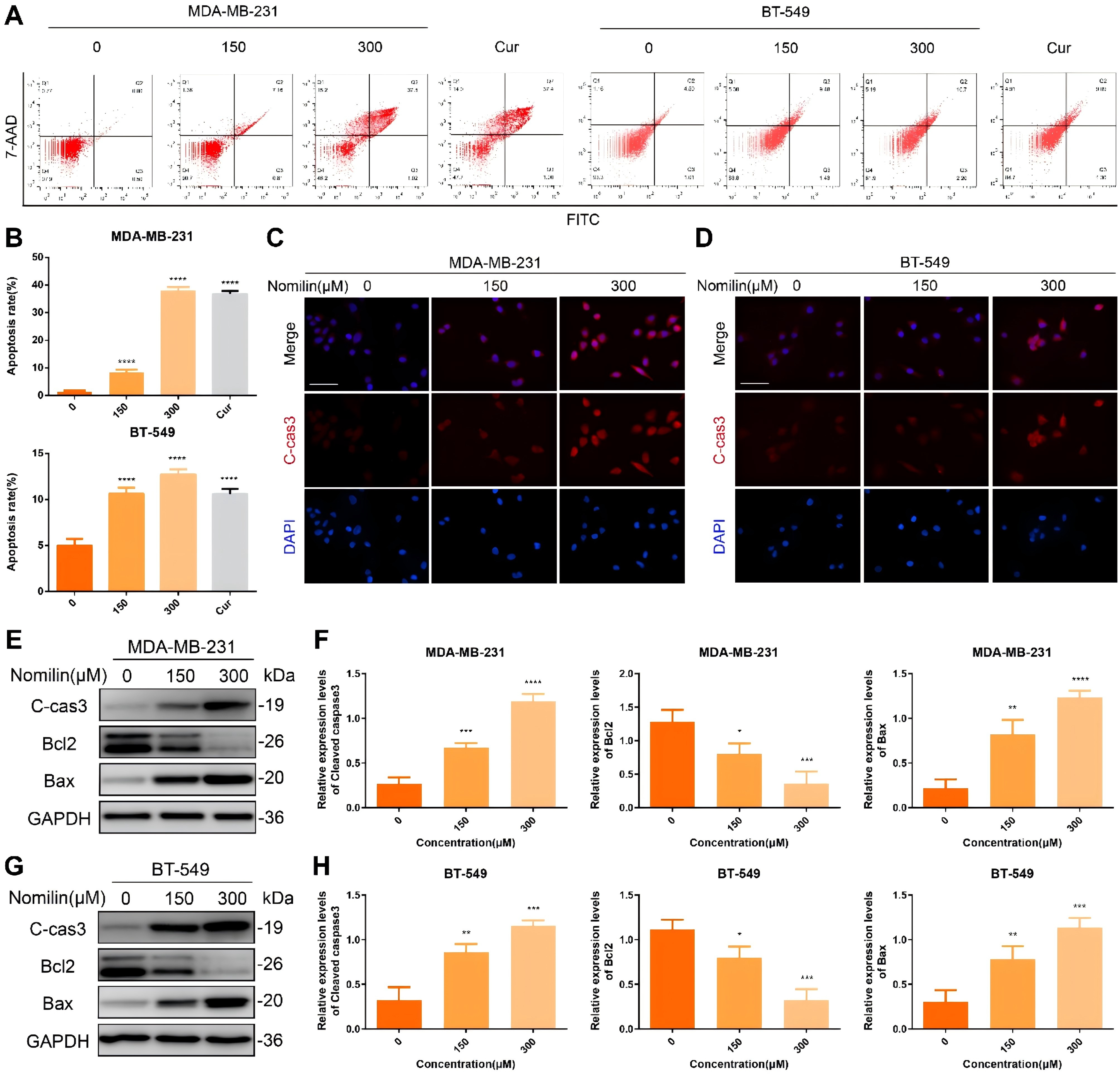

图8
9、诺米林对PI3K/Akt通路的影响
KEGG的研究结果表明,诺米林可能通过介导PI3K/Akt通路对抗肿瘤坏死细胞产生重要影响。随后,对诺米林在调节PI3K/Akt通路中的作用进行了全面研究。定量WB分析显示,诺米林可降低TNBCCs中p-PI3K和p-Akt的表达,而PI3K和Akt的表达则不受影响(图9A-D)。Akt能够使mTOR磷酸化,从而促进细胞周期蛋白CyclinD1的上调,并促进从G1期向S期的过渡。因此,作者评估了诺米林对CyclinD1表达的影响。与网络药理学发现一致,WB结果显示诺米林有效地抑制了CyclinD1的表达。综合这些实验结果,证实了诺米林通过PI3K/Akt/CyclinD1通路发挥其抗TNBC效应。
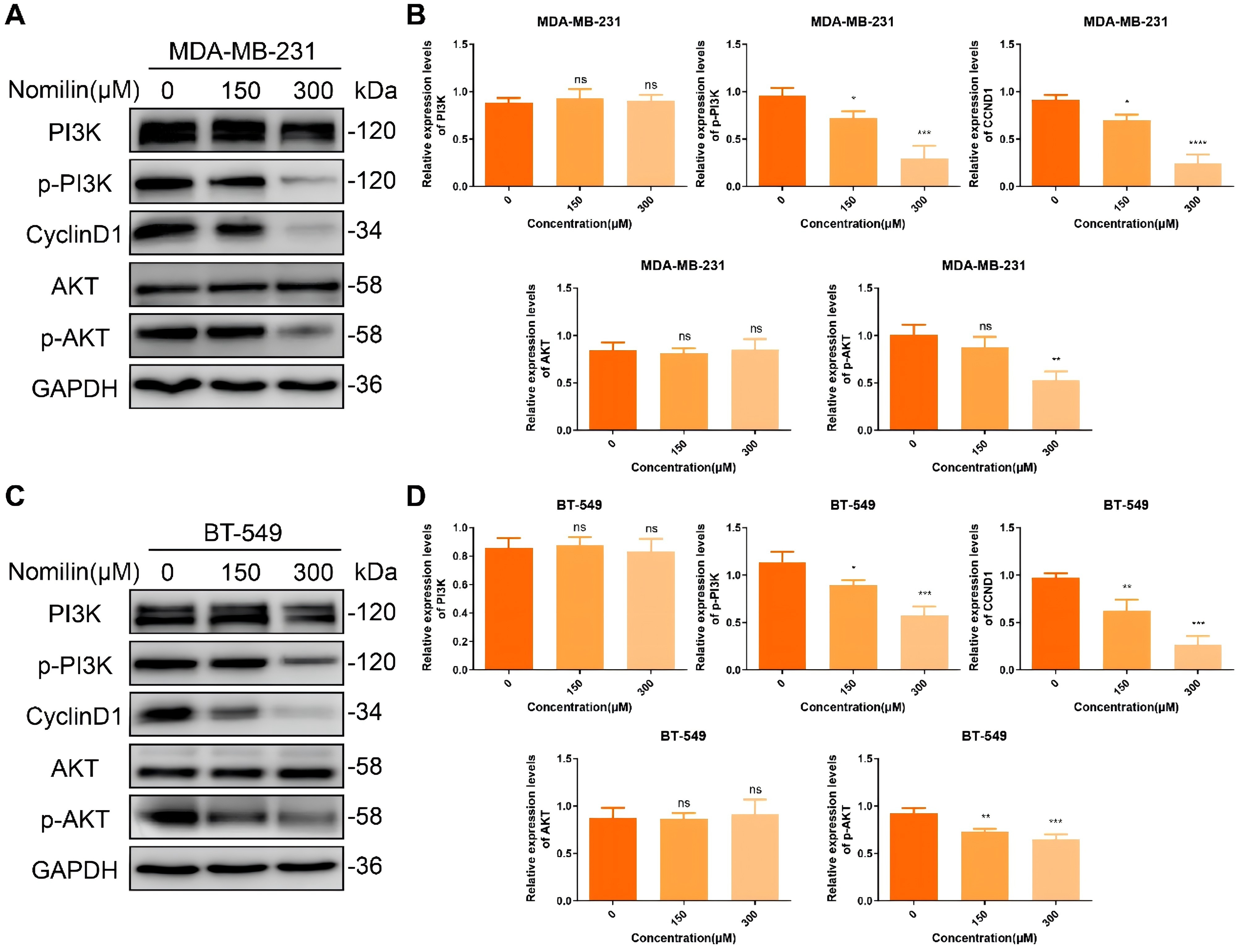
图9
10、诺米林可抑制TNBC异种移植瘤在裸鼠体内的生长
如图10A-C所示,与对照组相比,经诺米林治疗的裸鼠的肿瘤体积和质量明显缩小。此外,经HE染色证实,诺米林没有明显毒性(图10D)。肿瘤组织的H&E染色显示肿瘤细胞增殖受到抑制(图10E)。此外,体外实验结果表明,诺米林可上调BAX和裂解-Caspase3的表达,表明诺米林可通过线粒体依赖途径诱导肿瘤细胞凋亡(图10E-G)。从机理上讲,免疫组化结果表明,诺米林降低了p-Akt的水平(图10H)。总之,这些研究结果表明,诺米林可有效抑制体内肿瘤的生长,并具有良好的安全性。
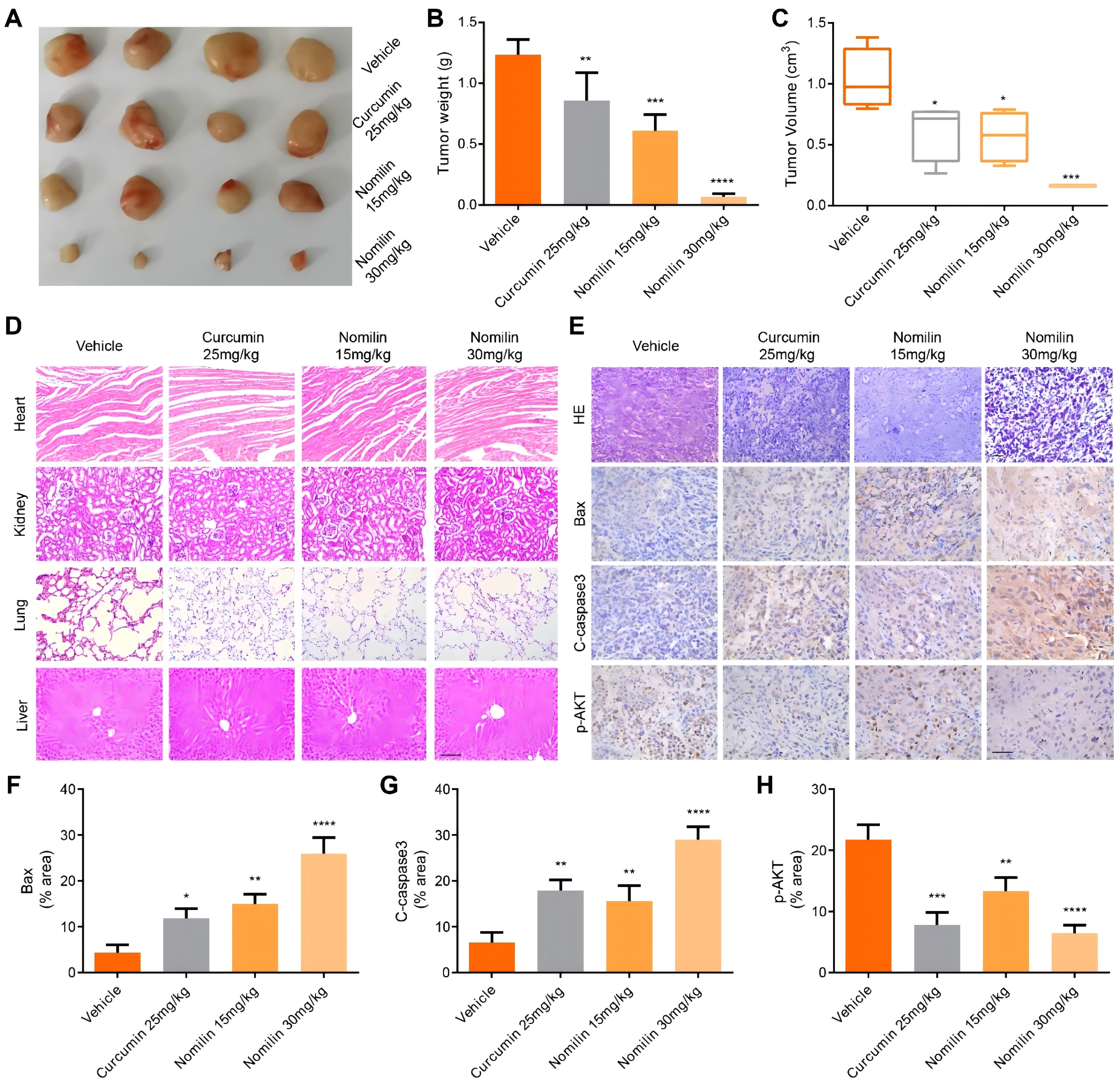
图10
总结:该研究first利用网络药理学、分子对接、分子动力学模拟、蛋白质组芯片和实验证实等方法,有效地发现了诺米林抗击 TNBC 的目的和机制,为治疗 TNBC 带来了希望。网络药理学研究是药物研究的神器,研究套路完善,有深度,非常值得模仿!




