Q1区7.7分,国自然热点研究案例:网络毒理学+分析对接+乳酸化+实验机制解析!!!
题目:低水平暴露于BDE-47会通过TOP2A/LDHA/乳酸化正反馈回路促进前列腺癌的发展
英文名:Low level exposure to BDE-47 facilitates the development of prostate cancer through TOP2A/LDHA/lactylation positive feedback circuit
杂志:Environmental Research
影响因子:7.7
发表时间:2024年10月
研究背景:2,2′,4,4′-四溴化二苯醚(BDE-47)是一种阻燃剂,有半挥发性、高毒性、生物累积性,是一种有机污染物(POPs)。虽然BDE-47与激素依赖性癌症(如乳腺癌)的关系已得到证实,但之前的研究并未考察BDE-47暴露是否与前列腺癌(PCa)的发生有关。本研究旨在通过大量和单细胞RNA测序(scRNA-seq)分析以及体外和体内实验,研究BDE-47暴露对PCa进展的影响。
研究思路:基于比较毒物基因组学数据库(CTD)和癌症基因组图谱(TCGA),通过筛选和重叠获得了34个BDE-47相关基因和PCa相关基因。这些基因明显富集在脂肪酸代谢相关的GO通路中,从UniProt获得的BDE-47靶向基因中也在这些术语富集。通过scRNA-seq数据,在男性PCa组织中观察到CYP2E1、PIK3R1、FGF2和TOP2A有一定的细胞类型特异性表达。分子对接模拟显示,BDE-47与AOXI、PIK3R1、FGF2、CAV2、CYP2E1和TOP2A的蛋白残基紧密结合。根据患者总生存率、接收者操作特征曲线(ROC)和格里森评分分级系统进行进一步筛选后,候选基因的范围缩小到了TOP2A。从机理上讲,TOP2A抑制剂可以逆转BDE-47对PCa细胞的生长促进作用。随后的RNA-seq实验表明,TOP2A通过上调LDHA和糖酵解促进了PCa的进展。此外,乳酸通过乳化PCa细胞中的H3K18la上调了TOP2A的转录,而LDHA的敲除可以挽救这种情况。综上所述,低剂量BDE-47通过TOP2A/LDHA/乳酸化正反馈回路触发PCa进展,从而揭示了BDE-47诱导前列腺癌发生的表观遗传学转变和代谢重编程的基础。
研究结果:
1、低剂量BDE-47可诱发体外和体内PCa的进展
首先,应用CCK-8试验评估BDE-47对细胞的毒性。PCa细胞(PC3和LNCaP)暴露于BDE-47(0-10pM)。给予BDE-47后,分别在4、8、12或24小时后评估细胞存活率。结果表明,BDE-47的浓度为0、0.01、0.1或1pM时,细胞活力均无明显变化。另一方面,当浓度为10pM时,PCa细胞的活力开始显著下降。考虑到BDE-47的细胞毒性和人体暴露情况,选择了低剂量(0.01和0.1qM)进行进一步实验,探讨了低剂量(0.01和0.1qM)BDE-47对PC3和LNCaP细胞生长的影响。一系列体外实验表明,低剂量BDE-47以剂量依赖的方式促进了PC3和LNCaP细胞的增殖(图1A-C)、迁移(图1D-G)和侵袭(图1H-I)。随后,还在体内研究了低剂量BDE-47对PCa细胞的影响。发现,与对照组相比,BDE-47组的肿瘤重量呈明显的剂量依赖性增加趋势(图1J-K)。此外,还通过H&E染色对肿瘤组织学进行了评估。在所有三个组中,发现在肿瘤组织中,细胞核与细胞质的比率无一例外地相对较高。与对照组的肿瘤组织形态相比,BDE-47组中检测到更多的空泡和核染色过深的细胞(图IL)。上皮细胞向间充质转化(EMT)是癌症进展过程中的一个关键事件。上皮和间质标记是EMT的标志,对小鼠肿瘤组织的IHC染色显示,间质标记物(N-cadherin和波形蛋白)的表达水平与BDE-47剂量呈正相关(图1L-M)。相反,检测到上皮标志物(E-cadherin)的表达水平与BDE-47剂量呈负相关(图1L-M)。这可以解释为BDE-47会引发PCa细胞在体内的进展。
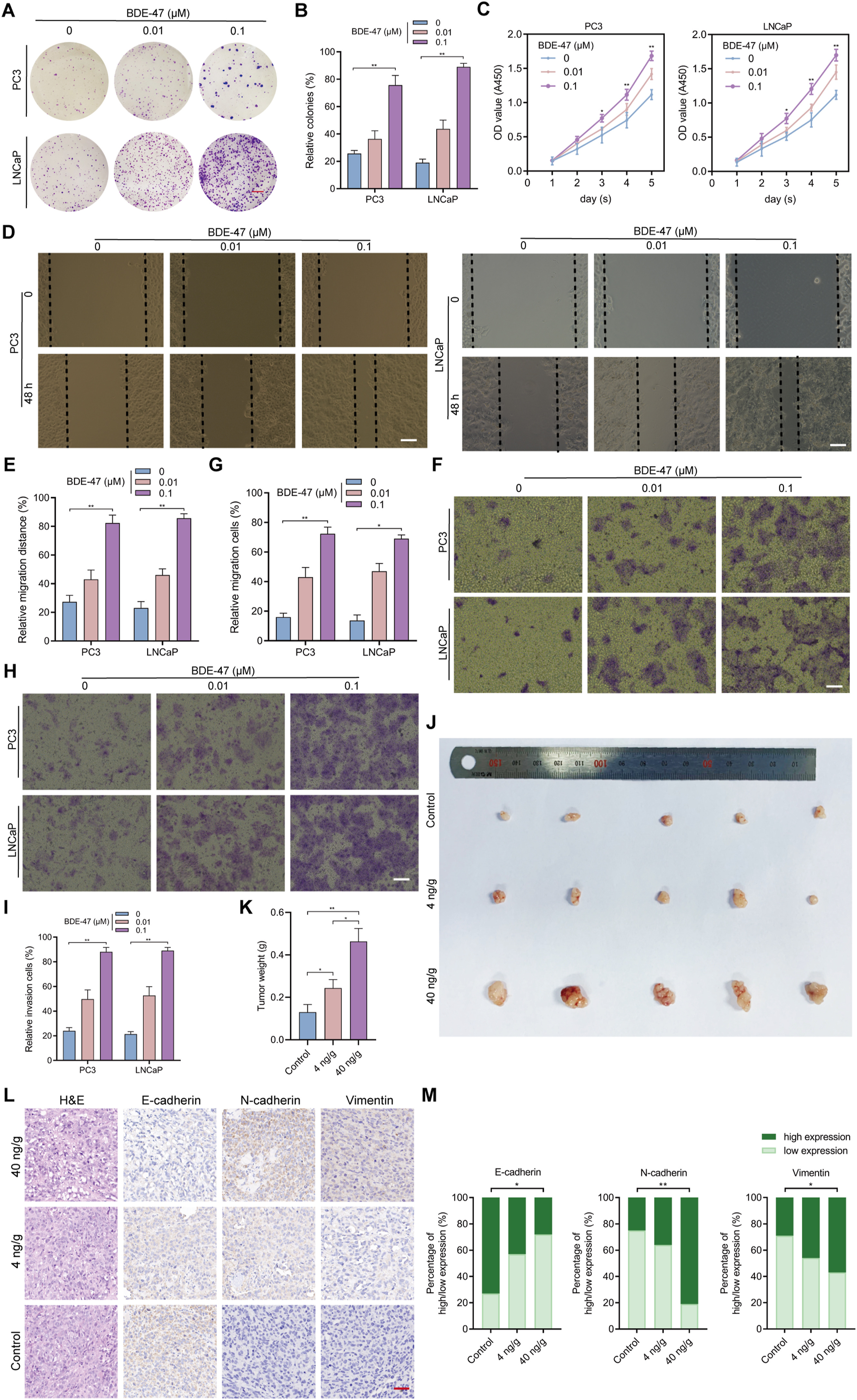

图1
2、PCa相关基因和BDE-47相关基因的鉴定和富集
基于TCGA的正常前列腺和PCa组织样本,进行了差异基因表达分析,得到了正常前列腺和PCa样本之间的2983个DEGs。在这些DEGs中,1270个上调,1713个下调(图2A)。然后将这些DEGs与CTD数据库中的BDE-47相关基因和PCa相关基因进行交叉,结果发现了34个重叠基因(图2B)。根据这些重叠基因,进行了GO和KEGG注释(图2C-D)。GO富集的结果包括脂肪酸代谢、激素分解代谢过程、对氧化应激的响应等通路(图2C),KEGG通路包括类固醇激素合成和许多化疗药抗性相关通路(图2D-E)。此外,有29个重叠基因被用于构建PPI网络,该网络包含140条边(图2F)。在这29个重叠基因中,UGT2B15、MMP9、FOLH1、EPCAM、HSD17B3、TOP2A、GDF15、AMACR和GNMT上调,而其他20个基因下调(图2F)
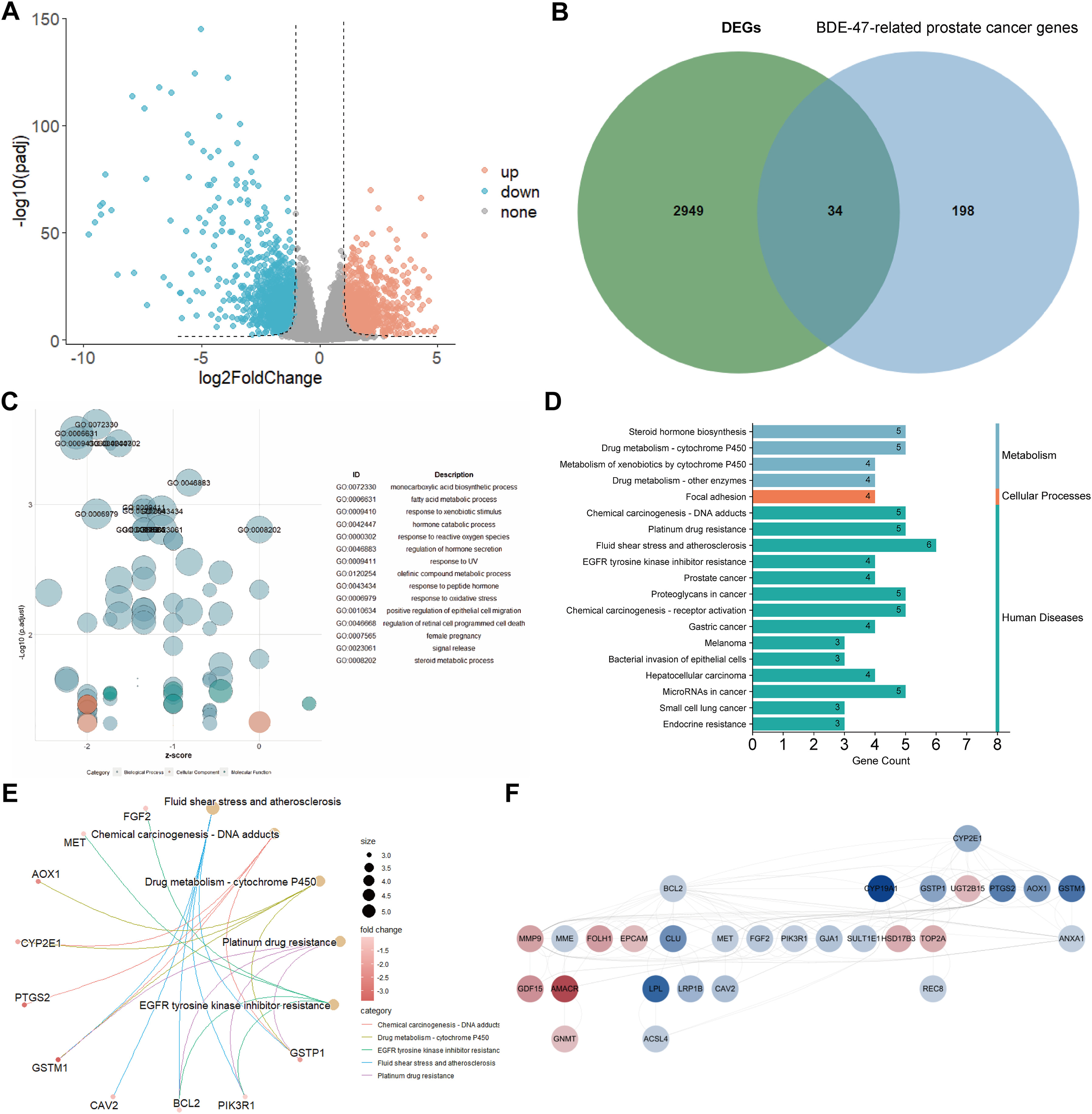
图2
3、筛选PCa的预后相关基因和诊断相关基因
为了探讨PCa组织中基因表达与总生存率的相关性,从TCGA中提取了重叠基因的mRNA水平和PRAD病例的临床信息。结果发现,12个重叠基因在低表达和高表达的PCa病例之间的总生存率存在显著差异,包括AOX1(图3A)、CAV2(图3B)、CYP2E1(图3C)、FGF2(图3D)、LRP1B(图3E)、GJA1(图3F)、LPL(图3G)、HSD17B3(图3H)、TOP2A(图3I)、MET(图3J)、PIK3R1(图3K)和SULTIEl(图3L)。

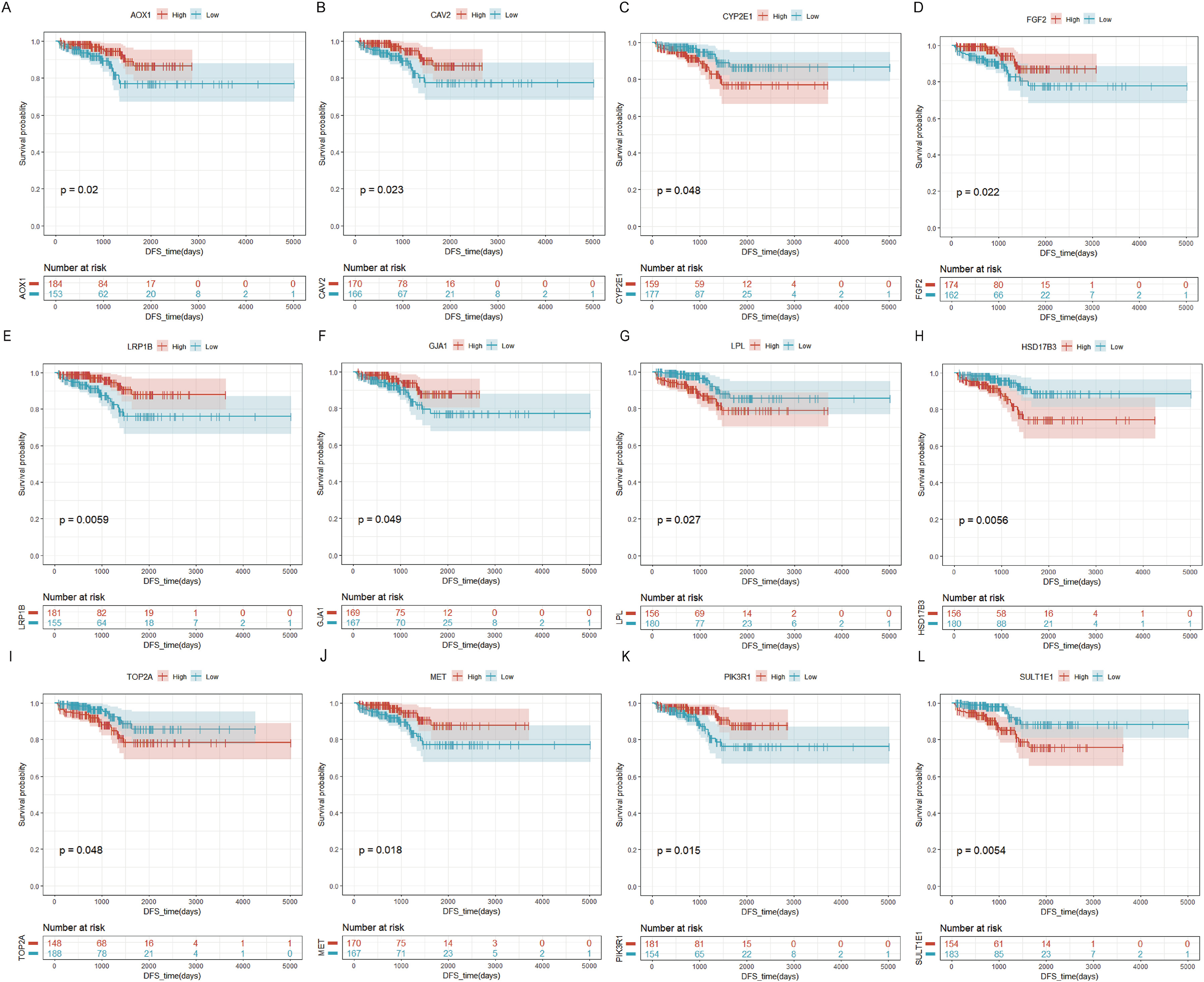
图3
根据TCGA和GTEx数据库中的正常前列腺和PCa样本,利用ROC曲线进一步评估了各重叠基因在PCa中的诊断价值。结果显示,AOX1(图4A)、FGF2(图4B)、CAV2(图4C)、CYP2E1(图4D)、TOP2A(图4E)、LRPIB(图4F)和PIK3R1(图4G)等7个基因的AUC均超过0.8,具有很好或突出的诊断价值。
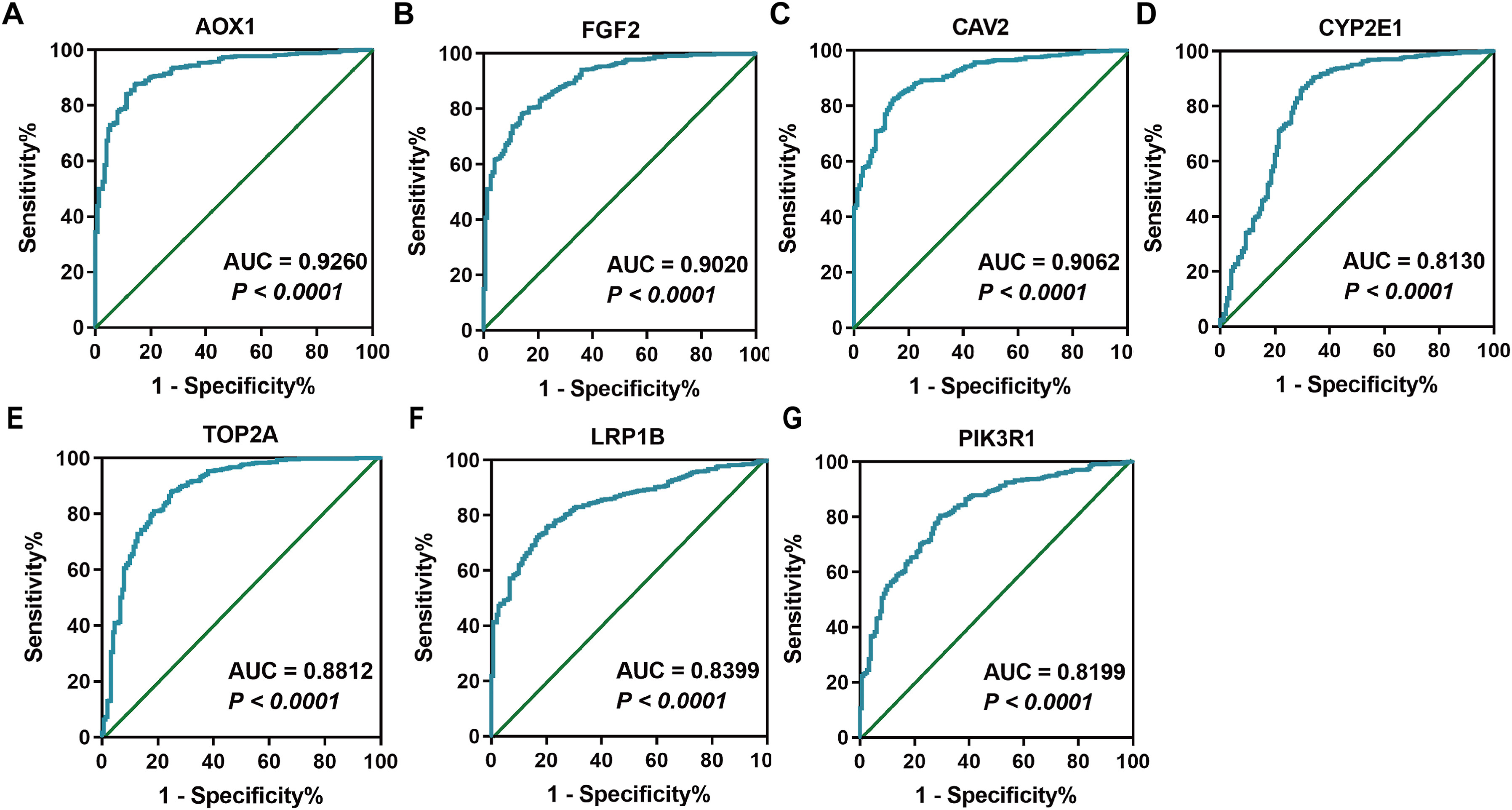
图4
4、分子对接和药物靶点分析
为了预测BDE-47的结合位点和蛋白质结构,进行了分子对接。经过这一筛选步骤后,还剩下6个基因。对接结果显示,AOX1、PIK3R1、FGF2、CAV2、CYP2E1和TOP2A的对接得分相对较高,BDE-47通过H键与这些蛋白残基紧密结合(图5a-F)。此外,还通过UniProt数据库获得了BDE-47的277个靶基因,并进行了GO术语富集,富集结果主要包括脂肪酸β-氧化、脂肪酰-CoA结合和其他脂肪酸代谢相关通路(图5G),这意味着BDE-47可能在很大程度上影响了PCa的脂肪酸代谢。

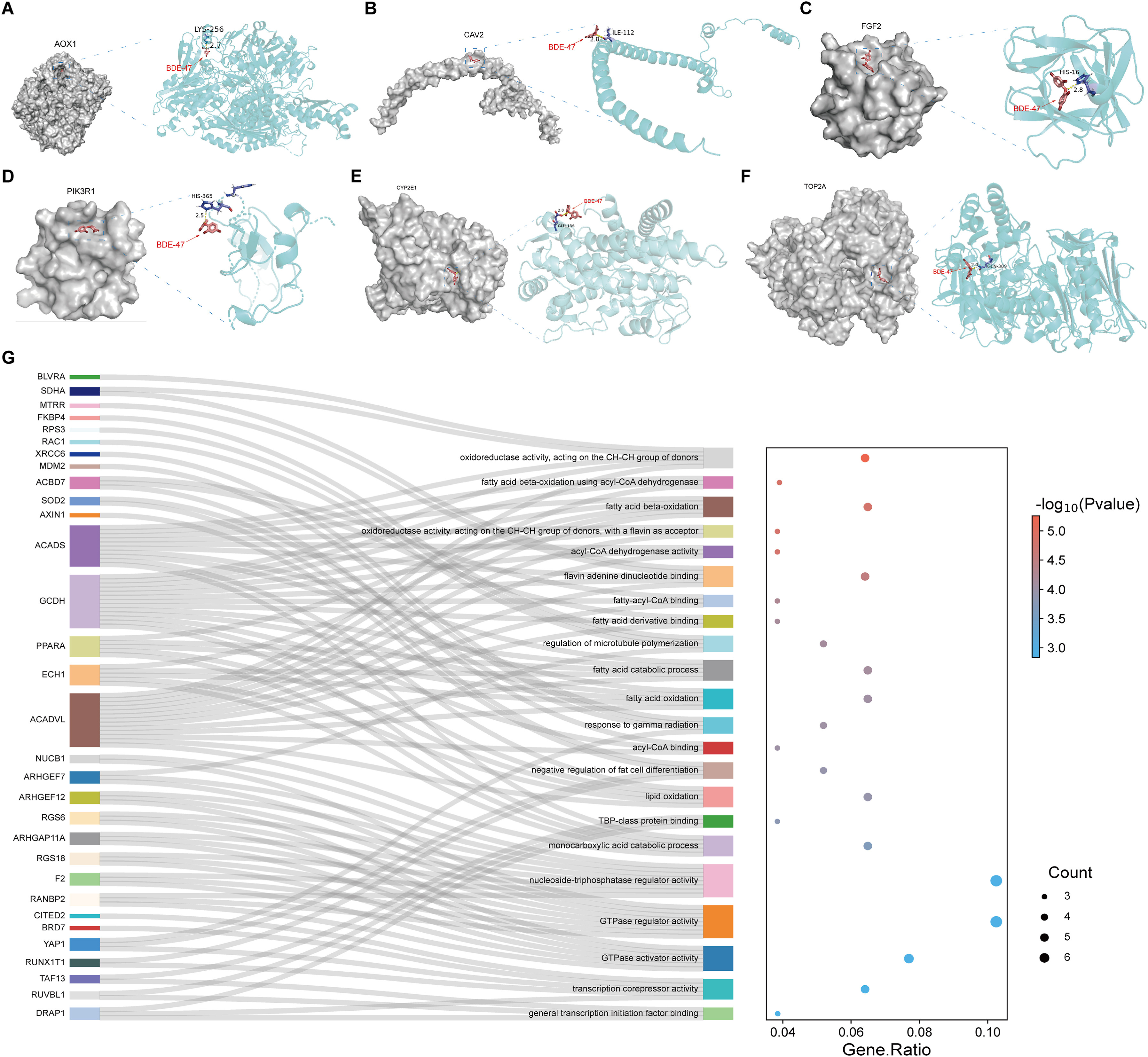
图5
5、前列腺不同细胞类型中基因的表达分布
为了探索其余6个基因在前列腺内不同细胞类型中的表达分布,通过分析scRNA-seq数据,注释了前列腺组织样本中的11种细胞类型(图6A),每个marker基因都表现出相应细胞类型特异性的高表达(图6B)。正常前列腺组织样本和PCa组织样本的整体基因表达分布存在明显差异(图6C)。在不同细胞类型中,基底上皮(BE)和管腔上皮(LE)的细胞数量比例highest(图6D)。与正常前列腺样本相比,PCa样本中LE的细胞数比例较高,而BE的细胞数比例较低(图6E)。此外,还研究了其余6个基因在正常前列腺样本和PCa样本中的表达分布,观察发现,CYP2E1在正常前列腺和PCa样本中具有高度特异性表达(图6F)。
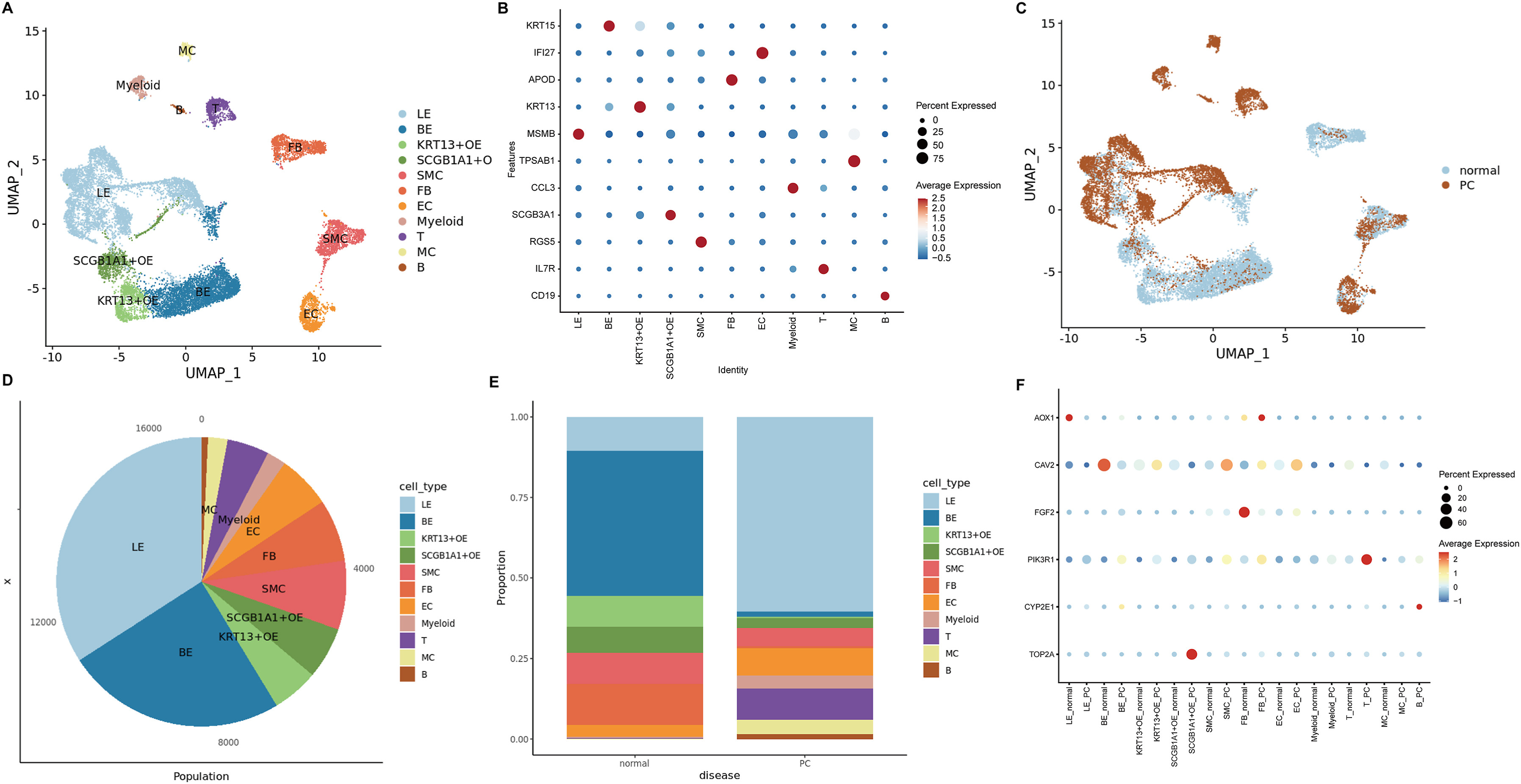
图6
6、低剂量BDE-47通过上调TOP2A促进PCa的进展
为了研究基因表达水平与PCa组织Gleason评分的相关性,比较了18例Gleason评分为≤6的PCa样本和47例Gleason评分为≥7的PCa样本中其余6个基因的表达水平。TOP2A在Gleason评分为≥7的PCa样本中的表达水平明显高于Gleason评分为≤6的样本(图7A)。相比之下,其他5个基因的表达水平在Gleason评分≥7分的PCa样本和Gleason评分≤6分的PCa样本中没有明显差异。此外,在PC3和LNCaP细胞中检测到的TOP2A蛋白水平明显高于WPMY-1细胞(图7B)。为了研究TOP2A表达对PCa细胞进展的影响,用低剂量(0.01pM)BDE-47处理PC3或LNCaP细胞,同时使用/不使用TOP2A抑制剂ICRF-193。事实证明,低剂量BDE-47能上调PC3和LNCaP细胞的增殖,而TOP2A抑制剂ICRF-193则能挽救这种增殖(图7C-E)。同样,研究发现低剂量BDE-47可促进PC3和LNCaP细胞的迁移能力(图7F-I)和侵袭能力(图7J和K),ICRF-193可缓解这种情况(图7F-K)。
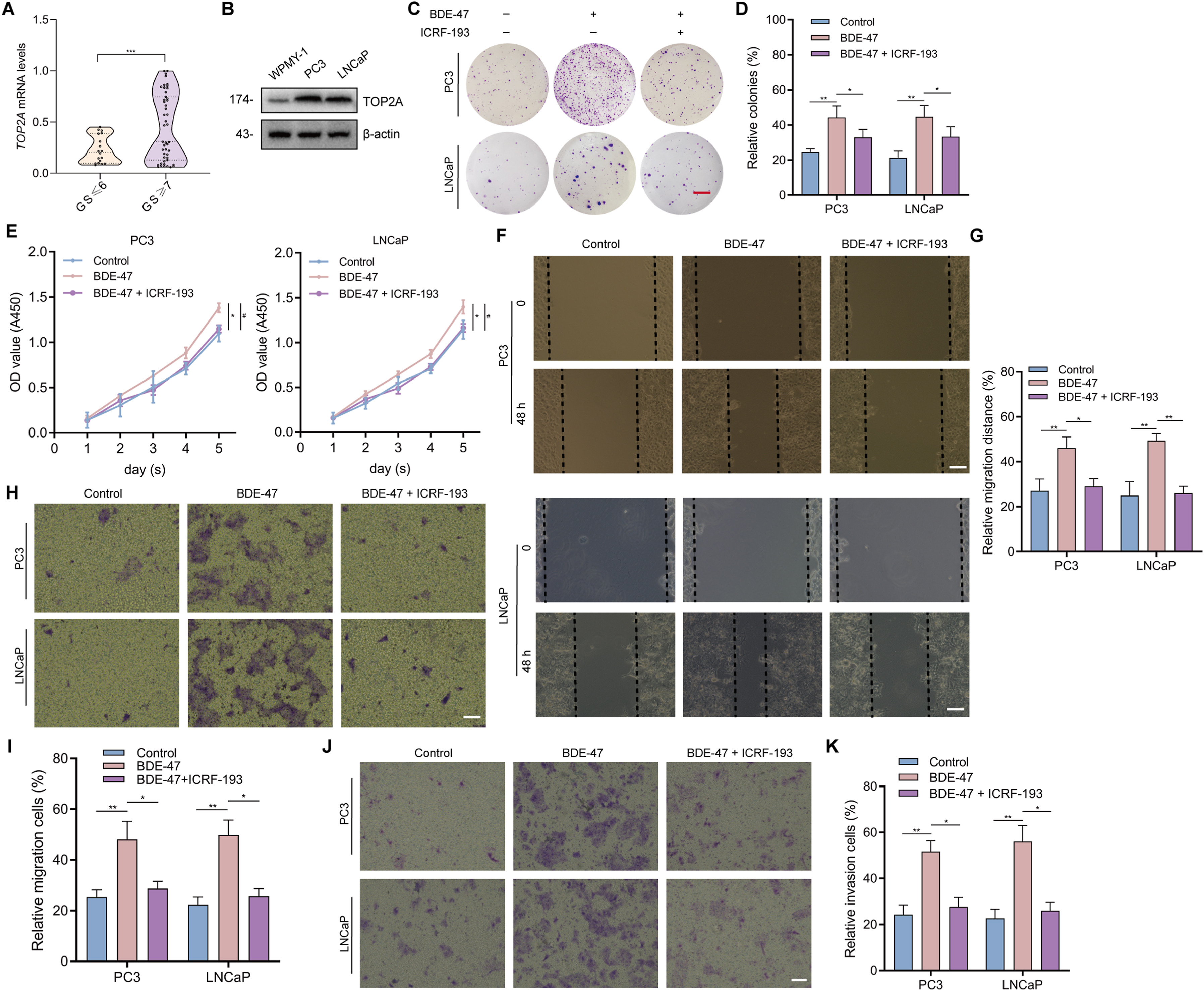
图7
7、TOP2A可通过上调LDHA和糖酵解
为了研究TOP2A引发PCa进展的分子机制,分别将TOP2A siRNA转染到PC3和LNCaP细胞中(图8A)。对转染了TOP2A siRNA的PC3细胞进行了RNA-Seq测序,富集分析显示,TOP2A基因敲除对丙酮酸代谢、氧化磷酸化和癌症中枢碳代谢有显著影响(图8B)。值得注意的是,丙酮酸代谢具有highest的富集指数(图8B)。在丙酮酸代谢通路中的DEGs中,AKR1A1、ACOT12、LDHA、LDHC和ALDH7A1在TOP2A敲除后均表现出显著且相似的下调(图8C)。用qPCR验证了TOP2A敲除对PCa细胞中AKRIAI、ACOT12、LDHA、LDHC和ALDH7A1mRNA水平的影响。结果发现,TOP2A敲除后,PC3和LNCaP细胞中AKR1A1和LDHA的mRNA水平同时下调(图8D)。此外,WB分析表明,TOP2A基因敲除后,PC3和LNCaP细胞中LDHA同时下调,而AIfR1A1没有下调(图8D-E)。此外,来自TCGA的转录组数据进一步证实了这一正向相关性。在PCa患者中,TOP2A和LDHA的mRNA水平之间存在差异(图8F)。此外,低剂量(0.01uM)BDE-47可上调PC3细胞中LDHA的蛋白水平,而TOP2A基因敲除可挽救LDHA的蛋白水平(图8G)。此外,TOP2A过表达也会上调PC3细胞中LDHA的蛋白水平(图8G)。此外,还发现敲除TOP2A会降低LDH活性(图8H)、葡萄糖摄取量(图8I)和乳酸浓度(图8J),这意味着敲除TOP2A对PCa细胞的糖酵解有抑制作用。

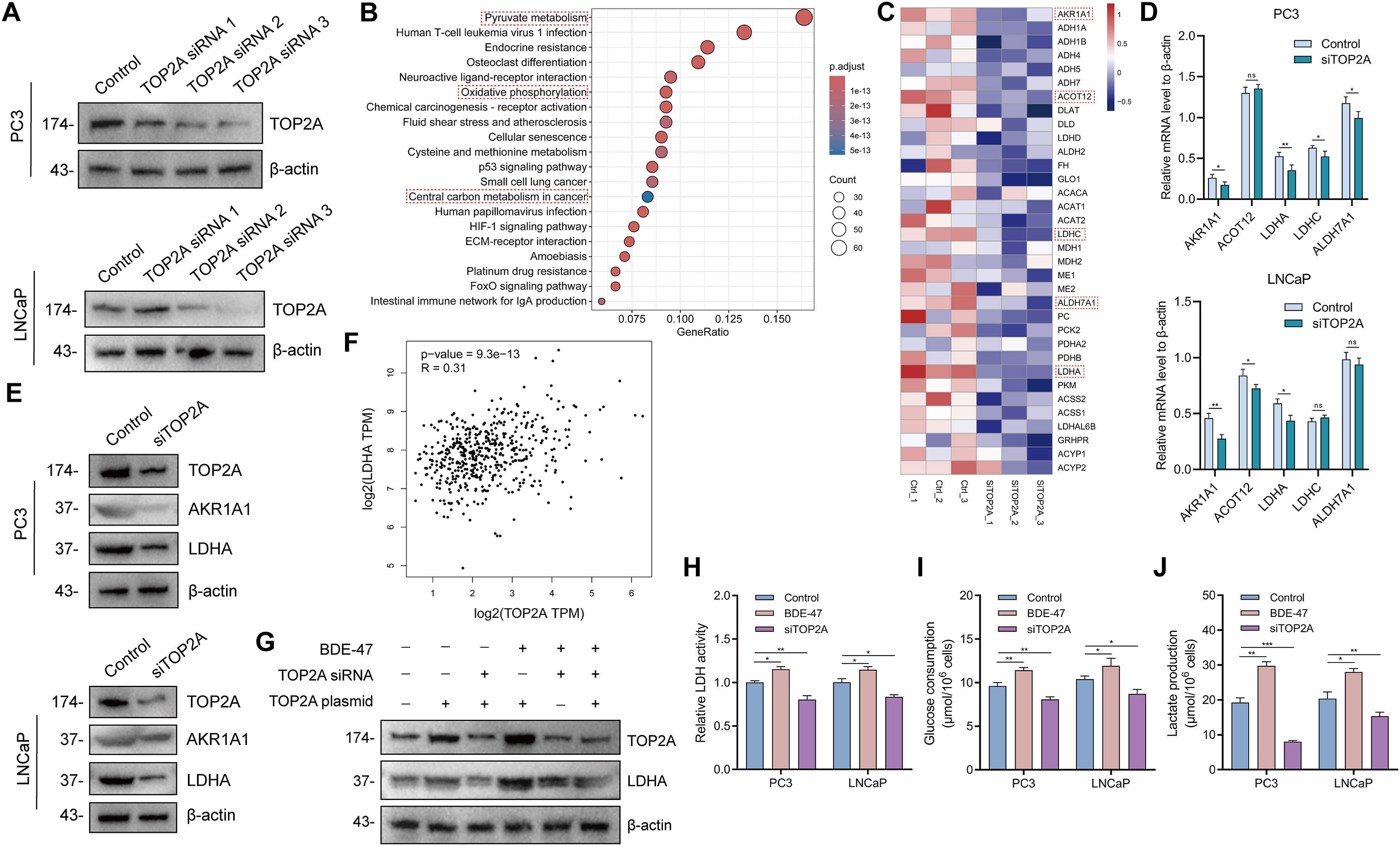
图8
接下来研究了TOP2A和LDHA的表达对PCa进展的影响。具体而言,体外实验表明,TOP2A敲除抑制了PC3和LNCaP细胞的增殖(图9A-C)、迁移(图9D-G)和侵袭(图9H和I)能力,而LDHA的过表达则可以挽救这些能力(图9A-I)。
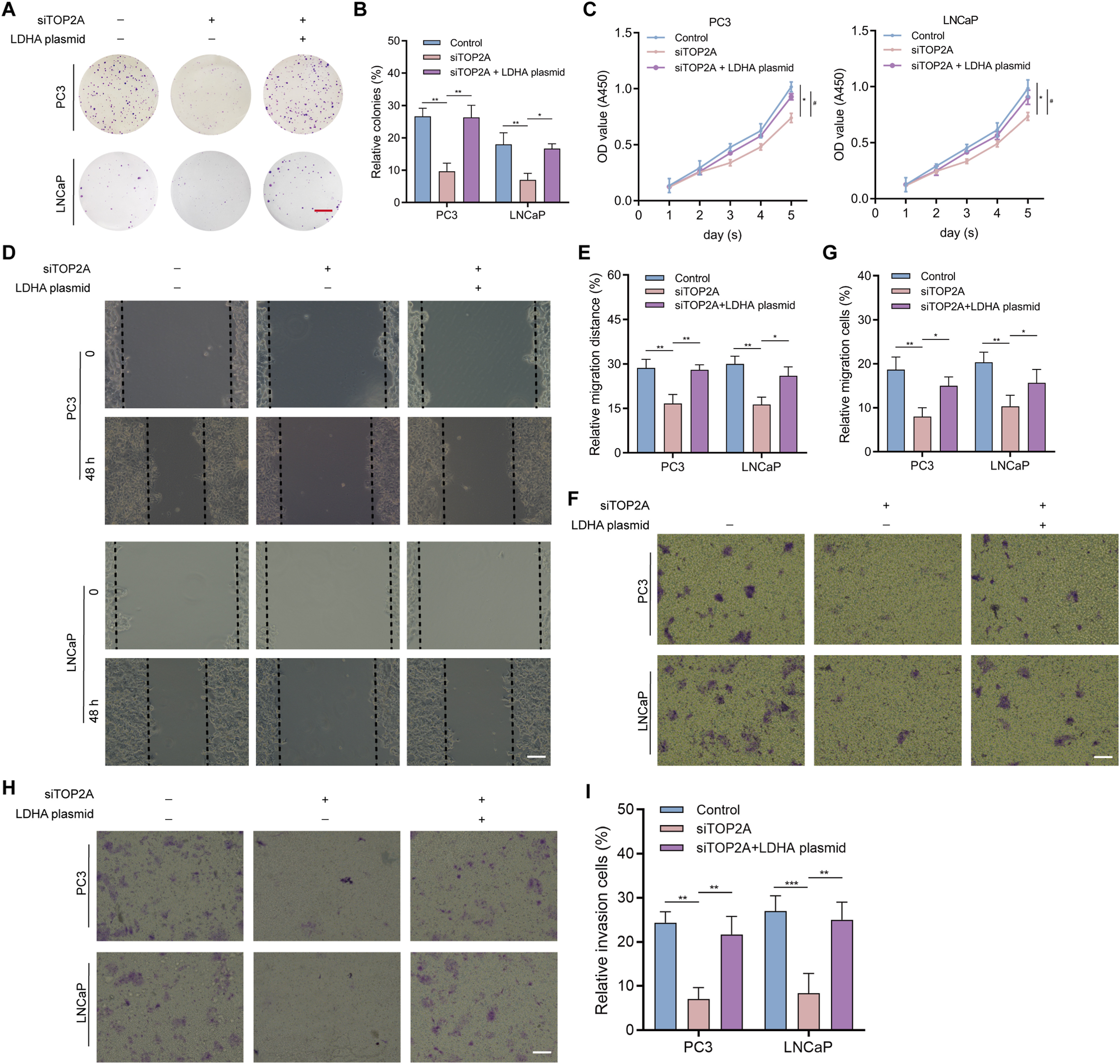
图9
8、乳酸盐通过H3K18的乳化作用促进TOP2A的转录
为了评估PCa细胞的组蛋白乳化情况,用一系列浓度的LA处理PC3细胞。结果显示,用LA处理后,PC3细胞中TOP2A、总乳化(Pan-Kla)和组蛋白乳化(H3K18la)的蛋白水平呈剂量依赖性上调(图10A)。此外,LDHA基因敲除会降低TOP2A、Pan-Kla和H3K18la的蛋白水平,而LA处理可以挽救这些蛋白水平(图10B)。考虑到组蛋白乳化会调控基因转录,研究了组蛋白乳化是否会影响TOP2A的转录。结果发现,LDHA敲除抑制了PC3细胞中H3K18与TOP2A启动子的结合活性,而用LA处理后这一效应被挽救(图10C)。此外,LDHA敲除会降低TOP2A的mRNA水平,LA处理后可逆转(图10D)。这些结果表明,LDHA或乳酸可通过组蛋白乳酸化上调TOP2A的转录。此外,研究还发现低剂量BDE-47可通过上调TOP2A/LDHA通路促进PCa的进展(图1-9)。基于上述证据,作者推断低剂量BDE-47诱导了TOP2A/LDHA/乳酸化正反馈回路,从而进一步促进了PCa的进展。

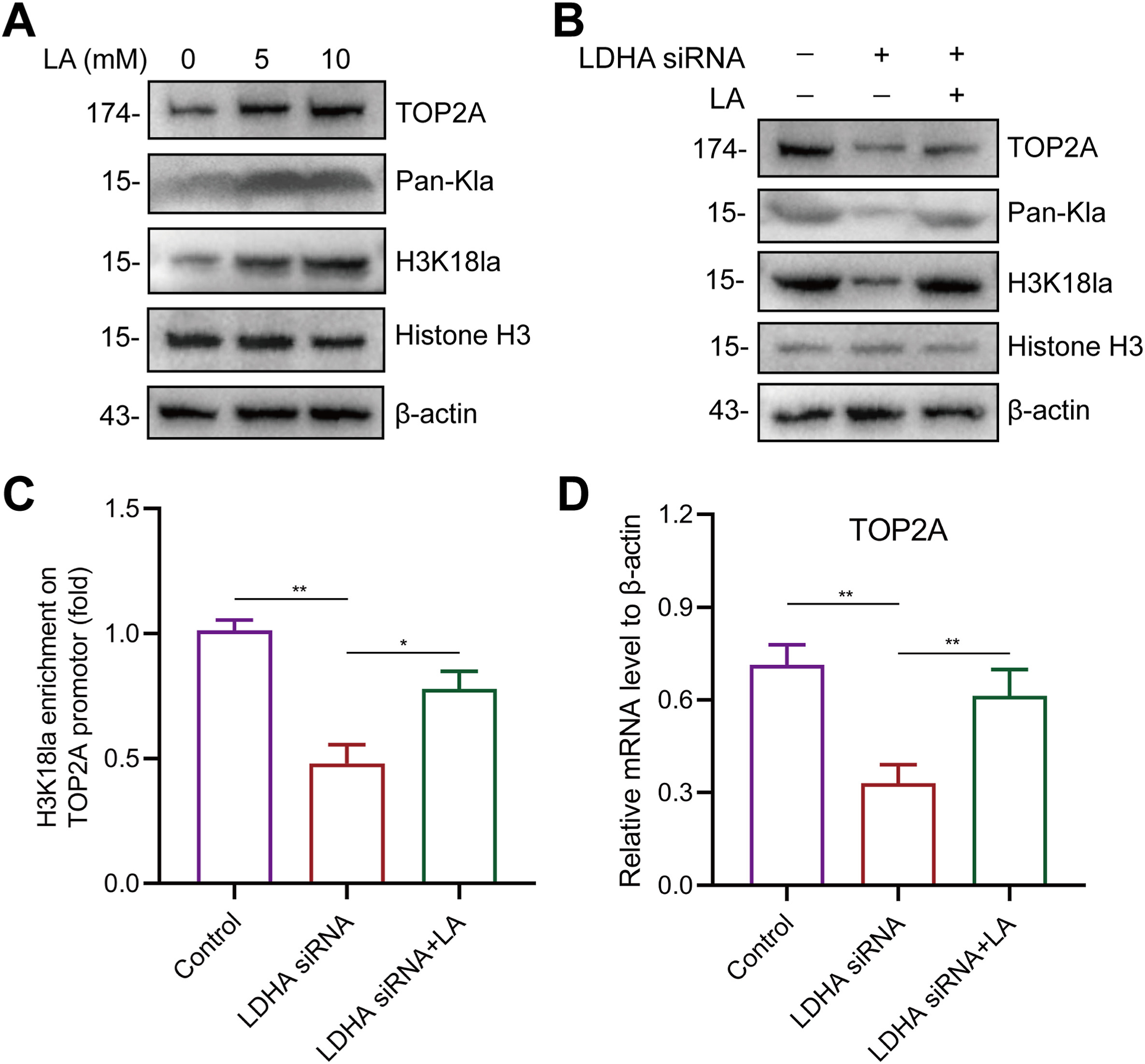
图10
总结:本文有很多热点研究内容,显得很新颖,另外还做了细致的实验,有力的分析了BDE-47暴露对前列腺癌发展的影响机制!傲星生物深耕生信分析十余载,有丰富的实验方案、完善的下游验证、机制研究服务,一对一专属服务为您排忧解难,助您轻松应对毕业和晋升!




